Таблица Менделеева – это основной источник информации о строении и свойствах химических элементов. Она представляет собой систематическое упорядочение всех известных науке элементов, где каждый элемент имеет свой уникальный порядковый номер. С помощью таблицы Менделеева можно легко получить информацию о химических свойствах, атомной массе, электронной конфигурации и других характеристиках элемента.
Один из основных параметров, который указывается в таблице Менделеева, – это номер подгруппы. Номер подгруппы отображает количество валентных электронов, т.е. электронов во внешнем энергетическом уровне атома. Возможные значения для номера подгруппы варьируют от 1 до 18, в зависимости от количества валентных электронов. Эта информация является ключевой для определения химических свойств элемента и его взаимодействий с другими элементами.
Например, элементы с номером подгруппы 1 имеют всего один валентный электрон во внешнем уровне и, как правило, обладают химической активностью. Это связано с тем, что эти элементы стремятся отдать свой единственный электрон и достичь стабильной электронной конфигурации алконового газа. Такие элементы, как литий, натрий и калий, известны своей реакционностью и способностью образовывать ионные соединения.
Понятие номера подгруппы
Номер подгруппы в таблице Менделеева представляет собой номер, который указывает на расположение элементов в периоде таблицы Менделеева. Он обозначается как верхний индекс справа от основного номера группы. Номер подгруппы определяет химические свойства, электронную конфигурацию и атомную структуру элементов.
Номер подгруппы является одним из ключевых характеристик элементов и важен для понимания их положения и свойств. Он позволяет легко определить, сколько электронов находится на внешнем энергетическом уровне элемента и какие свойства можно ожидать от него.
Каждая подгруппа в таблице Менделеева имеет свое название и особенности своих элементов. Например, в подгруппе VIII A находятся инертные газы, которые имеют полностью заполненные энергетические уровни и практически не проявляют химической активности. А в подгруппе I A расположены щелочные металлы, которые легко образуют ион положительного заряда.
Номер подгруппы полезен для классификации элементов и облегчает понимание и изучение химических свойств и реакций элементов. Он является важным инструментом для разработки новых материалов, рационального использования ресурсов и улучшения технологий на основе химических принципов.
Распределение элементов таблицы Менделеева

Номер подгруппы в таблице Менделеева указывает на количество электронов в последней заполненной электронной подоболочке. Они связаны с блоками элементов, такими как s, p, d или f блоки.
В общей сложности существует 18 подгрупп в таблице Менделеева. Подгруппы имеют номера от 1 до 18 и обозначаются буквами A и B. Подгруппы, обозначенные буквой A, включают элементы с заполненной внешней s-подоболочкой, а подгруппы, обозначенные буквой B, включают элементы с заполненной внешней d-подоболочкой.
Номер подгруппы может быть полезен для предсказания химических свойств элементов. Например, элементы с одинаковым номером подгруппы имеют сходные свойства, такие как окислительные свойства или способность к образованию соединений.
Однако, не все элементы имеют номер подгруппы, так как некоторые элементы расположены в зоне переходных металлов и не имеют четко определенного номера подгруппы.
Общая структура таблицы Менделеева и номера подгруппы помогают упорядочить элементы, позволяют делать предположения о их свойствах и предсказывать новые химические реакции и соединения.
Изучение химических свойств

При изучении химических свойств элементов и их соединений проводятся различные эксперименты, которые включают в себя:
- Определение точки плавления и кипения.
- Измерение плотности и температуры кипения.
- Анализ различных спектров (электронные, инфракрасные, ультрафиолетовые).
- Изучение реакций взаимодействия элементов и соединений.
Изучение химических свойств позволяет не только получить информацию о конкретном элементе или соединении, но и классифицировать их по различным признакам. Например, элементы, которые обладают сходными химическими свойствами, могут быть объединены в группы и подгруппы в таблице Менделеева.
Номер подгруппы в таблице Менделеева указывает на количество электронов в внешней оболочке атома, что является важным фактором в их взаимодействии. Кроме того, подгруппы обозначают такие химические свойства, как валентность и реакционную способность элементов.
Параллельное расположение валентных электронов

Расположение валентных электронов имеет огромное значение для понимания химической активности элементов и их способности образовывать связи. В таблице Менделеева, номер подгруппы показывает количество валентных электронов у элемента.
Например, валентные электроны элементов из группы 1 (алкалии) находятся в s-подуровне, поэтому группа 1 состоит из одной подгруппы с одним валентным электроном. Это означает, что элементы этой группы имеют одну внешнюю оболочку с одним электроном. Также, у элементов из группы 13 (боры) есть по 3 валентных электрона.
Параллельное расположение валентных электронов позволяет определить химические свойства и реактивность элементов. Знание числа валентных электронов элемента позволяет предсказать, какие связи он образует и с какими элементами легко реагирует.
Влияние на реакционную способность элементов
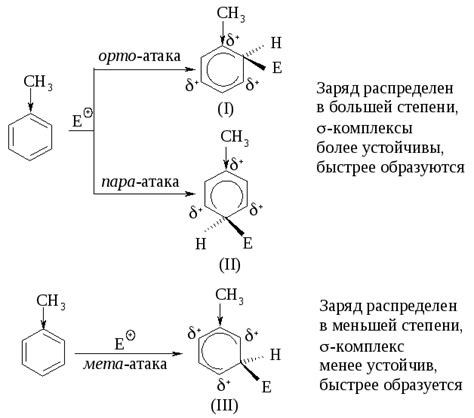
Номер подгруппы в таблице Менделеева играет важную роль в определении химической активности элементов. Он указывает на количество электронов в внешней оболочке атома элемента, что непосредственно влияет на его реакционную способность.
Элементы, расположенные в одной подгруппе, имеют одинаковое число электронов в внешней оболочке и, следовательно, схожие свойства и реакционную способность. Например, элементы первой группы (литий, натрий, калий и др.) имеют один электрон в внешней оболочке и легко отдают его, образуя положительные ионы. Они проявляют ярко выраженные химические свойства и сильно реакционны.
Вторая подгруппа включает элементы с двумя электронами в внешней оболочке, такими как бериллий, магний и др. Они образуют ионы с двойным положительным зарядом и также обладают высокой реакционной способностью, но уже не такой выраженной, как у элементов первой группы.
По мере движения по таблице Менделеева к правому краю, число электронов в внешней оболочке увеличивается, что приводит к снижению реакционной способности элементов. Элементы последних подгрупп, например, инертные газы (гелий, неон и др.), имеют полностью заполненные внешние оболочки и поэтому практически не образуют химические связи и не реагируют с другими элементами.
Таким образом, номер подгруппы в таблице Менделеева является важным дескриптором реакционной способности элементов и позволяет предсказать их химическое поведение.
Определение химической активности

Если элемент находится в группе, у которой номер подгруппы равен 1, то это означает, что элемент имеет наибольшую химическую активность и является самым активным химическим металлом. Эти элементы легко окисляются и образуют положительные ионы.
Элементы, находящиеся в группах с номерами подгрупп от 2 до 12, называются переходными металлами. Они обладают средней химической активностью и могут образовывать различные оксиды и ионы.
Элементы из последних групп - группы 13-18 - называются неметаллами или инертными газами. Они имеют наиболее низкую химическую активность и обычно не вступают в химические реакции.
Таким образом, номер подгруппы в таблице Менделеева помогает определить химическую активность элемента и его способность взаимодействовать с другими веществами. Это важная информация для понимания химических свойств и реакций элементов.
Связь с группой элементов
Номер подгруппы в таблице Менделеева показывает связь элемента с группой в таблице.
В таблице Менделеева элементы расположены в порядке возрастания атомного номера, который также определяет количество протонов в атоме элемента. Таким образом, элементы с одинаковым номером подгруппы имеют одинаковое количество электронов в внешней электронной оболочке.
Группа элементов обозначает общие свойства и валентность. Валентность элемента определяет его способность вступать в химические реакции и образовывать химические связи.
Номер подгруппы является важным параметром для определения характеристик элемента и его связи с другими элементами. Он позволяет классифицировать элементы схожими свойствами и предсказывать их поведение в химических реакциях.
Таблица Менделеева является основой современной химии и позволяет ученым систематизировать и изучать химические элементы, их свойства и взаимодействия.
| Группа | Подгруппа | Обозначение | Примеры элементов |
|---|---|---|---|
| 1 | 1A | Главные металлы | Литий (Li), Натрий (Na), Калий (K) |
| 2 | 2A | Щелочноземельные металлы | Бериллий (Be), Магний (Mg), Кальций (Ca) |
| 3-12 | B | Переходные металлы | Железо (Fe), Медь (Cu), Цинк (Zn) |
| 17 | 7A | Галогены | Фтор (F), Хлор (Cl), Бром (Br) |
| 18 | 8A | Благородные газы | Гелий (He), Неон (Ne), Аргон (Ar) |



