В атоме находится заряженное ядро, которое состоит из протонов и нейтронов. Протоны имеют положительный электрический заряд, а нейтроны не имеют заряда. От общего числа протонов и нейтронов зависит массовое число атома. Заряд ядра, в свою очередь, определяется количеством протонов. Оба эти параметра являются основными характеристиками ядра атома.
Массовое число обозначается символом A и указывается верхним индексом слева от символа химического элемента. Оно является целым числом и равно сумме протонов и нейтронов в ядре. Например, в атоме углерода массовое число равно 12, что означает наличие 6 протонов и примерно 6 нейтронов в его ядре.
Заряд ядра обозначается символом Z и указывается нижним индексом слева от символа химического элемента. Он равен количеству протонов в ядре. Например, у углерода заряд ядра равен 6, что соответствует количеству протонов. Заряд ядра отличается от общего заряда атома, так как атом нейтрален и имеет одинаковое количество электронов и протонов, что позволяет компенсировать их заряды.
Что такое заряд ядра

Протоны, находящиеся в ядре атома, имеют одинаковый положительный электрический заряд, равный элементарному положительному заряду. Это заряд помогает привлекать к себе отрицательно заряженные электроны, которые вращаются вокруг ядра на разных энергетических уровнях.
Заряд ядра определяет элементарный заряд – это фундаментальная постоянная, которая равна примерно 1,6 * 10^(-19) Кл. Это означает, что каждый протон в ядре обладает одним единичным положительным зарядом.
Заряд ядра можно выразить численно, применив формулу: Заряд ядра = (число протонов) * (заряд электрона).
Таким образом, заряд ядра играет важную роль в стабильности атома, определяя его взаимодействие с другими атомами и внешними электромагнитными полями.
Определение заряда ядра
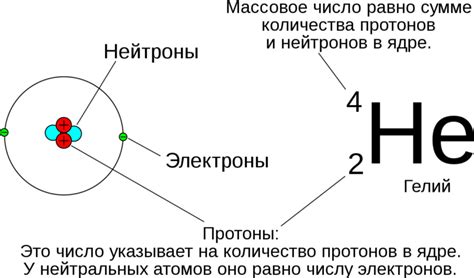
Частицы, составляющие ядро атома, называются нуклонами. Нуклоны делятся на два типа: протоны и нейтроны. Протоны имеют положительный электрический заряд, а нейтроны - не имеют заряда. Заряд ядра определяется суммой зарядов всех протонов, содержащихся в нем.
Заряд ядра влияет на взаимодействие атомов между собой и с окружающей средой. Вещества с разным зарядом ядра обладают разными физическими и химическими свойствами.
Заряд ядра измеряется в элементарных зарядах, обозначаемых буквой "е". Заряд одного протона составляет +1 е, а заряд одного нейтрона равен 0 е. Таким образом, общий заряд ядра равен сумме зарядов всех протонов в нем.
Роль заряда ядра

Заряд ядра определяется количеством элементарных частиц – протонов, которые находятся в ядре. Каждый протон имеет положительный электрический заряд, равный единице элементарного заряда. Сумма зарядов протонов в ядре определяет общий заряд ядра.
Заряд ядра играет важную роль в структуре атома. Электроны, вращающиеся вокруг ядра, притягиваются его положительным зарядом. Это взаимодействие ядра и электронов определяет свойства вещества, такие как химическая реактивность и связующие способности атомов.
Кроме того, заряд ядра влияет на стабильность атома. Силы притяжения между протонами в ядре и их отталкивание от электронов порождают ядерные силы, которые удерживают частицы вместе. Соотношение между зарядом ядра и числом нейтронов определяет стабильность атома и его способность подвергаться ядерным реакциям.
Таким образом, заряд ядра является существенной характеристикой атомного ядра, определяющей его свойства, структуру и взаимодействие с другими частицами.
Массовое число

Массовое число имеет особое значение для стабильности атомов. Чем больше массовое число, тем больше нуклонов в ядре, и, как правило, тем более стабильный атом. Некоторые элементы имеют несколько стабильных изотопов, которые отличаются массовыми числами. Например, углерод может иметь изотопы с массовым числом 12 и 14.
Массовое число также используется для определения относительной атомной массы элемента. Относительная атомная масса вычисляется как среднее массовых чисел всех изотопов элемента, учитывая их относительные проценты.
Определение массового числа

Массовое число показывает суммарную массу протонов и нейтронов в ядре атома. Протоны имеют массу, равную примерно 1 атомной единице (a.u.), а нейтроны - немного больше. Поэтому масса атомного ядра превышает общую массу протонов и нейтронов, которые его составляют, на несколько атомных единиц. Пример: массовое число углерода равно 12, так как в его ядре содержатся 6 протонов и примерно 6 нейтронов.
Знание массового числа элемента позволяет определить его массовую долю в природе. Например, по массовому числу можно узнать, что углерод-12 встречается чаще других изотопов углерода и составляет около 99% его природной массы.
Роль массового числа

Массовое число является фундаментальной характеристикой атома и указывает на количество нуклонов в его ядре. Протоны и нейтроны имеют практически равные массы, поэтому их сумма дает приближенное значение массы атома.
Массовое число записывается в верхнем индексе слева от символа химического элемента. Например, массовое число для атома кислорода равно 16.
Массовое число также определяет изотопы – атомы одного и того же элемента с разным числом нейтронов. Изотопы имеют одинаковое атомное число (число протонов в ядре), но разное массовое число.
Массовое число влияет на стабильность атома. Атомы с большим массовым числом могут быть нестабильными и распадаться по радиоактивному закону. Массовое число также влияет на химические свойства атома и его взаимодействия с другими атомами.
Изучение массового числа и его роли позволяет лучше понять строение атома и его свойства, а также применять полученные знания в различных областях науки и техники.



