Химические реакции играют ключевую роль в нашей жизни, они присутствуют повсюду: от пищеварения пищи в нашем организме до производства промышленных товаров. Понимание и контроль скорости химических реакций является одной из самых важных областей химии.
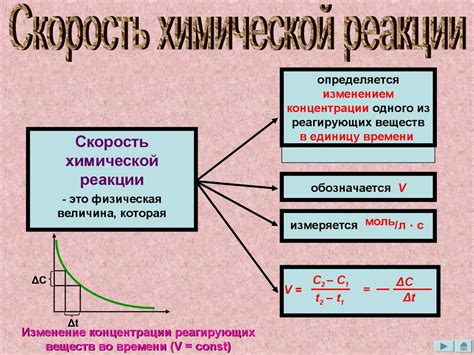
Скорость химической реакции определяет, насколько быстро или медленно происходит процесс превращения одних веществ в другие. Знание о скорости реакции позволяет нам улучшать и оптимизировать различные процессы, такие как производство лекарств, косметики, пищевых продуктов и многих других.
Скорость реакции также имеет прямое отношение к безопасности. Быстрые химические реакции могут быть опасными и вызывать взрывы или пожары. Поэтому знание скорости химической реакции позволяет предотвращать нежелательные последствия и принимать меры безопасности.
В данной статье мы рассмотрим основные причины, почему важно знать скорость химической реакции и как это знание может быть применено на практике.
Влияние скорости химической реакции на окружающую среду

1. Выделение тепла и энергии
Некоторые химические реакции сопровождаются выделением большого количества тепла или превращением энергии. Это может привести к изменению температуры окружающей среды и вызвать различные последствия, включая изменение климата или повреждение живых организмов.
2. Образование и удаление вредных веществ
Скорость реакции может влиять на образование или удаление веществ, которые могут оказывать негативное воздействие на окружающую среду. Некоторые химические реакции могут приводить к образованию токсичных веществ или выбросу загрязняющих веществ, которые загрязняют воду, воздух и почву.
3. Разложение и утилизация отходов
Скорость реакции влияет на процессы разложения и утилизации отходов. Быстрая реакция может способствовать разложению органических отходов, снижая их негативное воздействие на окружающую среду. Однако медленная реакция может привести к накоплению отходов и загрязнению окружающей среды.
4. Разрушение и сохранение биологических систем
Скорость химической реакции может иметь разрушительное или сохраняющее воздействие на биологические системы. Быстрая реакция может разрушить клетки или ткани организмов, тогда как медленная реакция может сохранить их структуру и функции.
Понимание и контроль скорости химической реакции существенны для сохранения биоразнообразия, экологической устойчивости и качества окружающей среды. Использование этих знаний позволяет разрабатывать экологически чистые технологии, проводить безопасные химические процессы и улучшать качество жизни.
Скорость химической реакции и энергия
Энергия активации – это минимальная энергия, которую необходимо подать системе реагирующих веществ для того, чтобы начать процесс превращения. На диаграмме энергетических уровней это представлено в виде холма, который нужно преодолеть, чтобы достичь конечных позиций продуктов.
Чем выше энергия активации, тем медленнее протекает химическая реакция. Поэтому знание скорости реакции и энергетических процессов, происходящих в системе, позволяет улучшать и контролировать химические процессы. Исследование зависимости скорости реакции от энергии активации также позволяет прогнозировать и оптимизировать различные химические преобразования.
| Примеры влияния энергии на скорость реакции: |
|---|
| 1. Катализаторы. |
| 2. Изменение концентрации реагентов. |
| 3. Температурные условия. |
Изучение скорости химической реакции и энергетических аспектов реакций позволяет разрабатывать новые материалы, синтезировать нужные вещества, а также улучшать существующие процессы в промышленности и медицине. Благодаря этому пониманию мы можем более эффективно использовать ресурсы и уменьшить отрицательное влияние процессов на окружающую среду.
Скорость химической реакции и равновесие
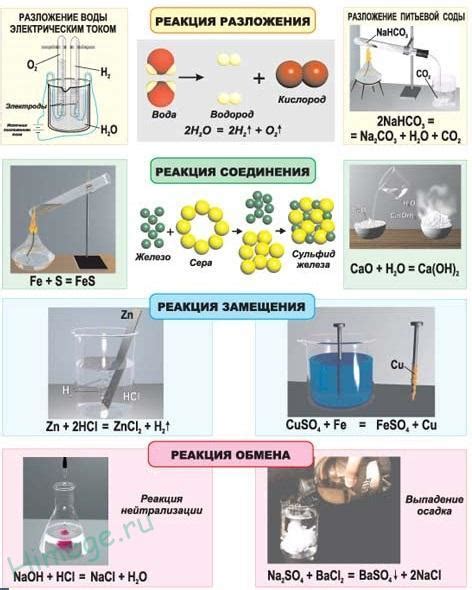
Одним из основных факторов, влияющих на скорость реакции, является равновесие химической системы. Равновесие достигается, когда скорость обратной реакции становится равной скорости прямой реакции. В этом случае концентрации реагентов и продуктов перестают изменяться со временем.
Изучение скорости химической реакции позволяет прогнозировать, какие условия и факторы могут изменить ее скорость, и каким образом можно контролировать протекание реакции. Например, зная скорость реакции, можно оптимизировать ее условия, чтобы сделать ее процесс более эффективным или ускорить его прохождение.
| Факторы, влияющие на скорость реакции: |
|---|
| Температура: повышение температуры обычно увеличивает скорость реакции, так как повышение температуры увеличивает энергию столкновений молекул. |
| Концентрация реагентов: увеличение концентрации реагентов увеличивает вероятность их столкновения и, следовательно, скорость реакции. |
| Катализаторы: добавление катализаторов может ускорить химическую реакцию, облегчая активацию реагентов и снижая энергию активации. |
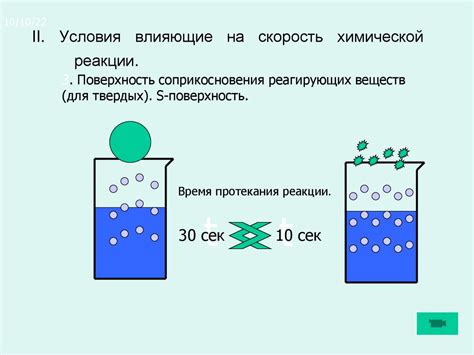
| Поверхность контакта: увеличение поверхности контакта реагентов может повысить скорость реакции, так как увеличивает количество активных центров реакции. |
Таким образом, понимание скорости химической реакции и ее взаимосвязи с равновесием позволяет эффективно контролировать и оптимизировать процессы в химической системе. Это имеет важное практическое применение в различных областях науки и технологии, включая промышленность, медицину, экологию и другие.
Скорость химической реакции и применение в промышленности

Одним из основных способов изменения скорости химической реакции является использование катализаторов. Катализаторы, будучи добавленными в реакцию, активируют молекулярные переходы и ускоряют протекание процесса. Использование катализаторов позволяет снизить температуру и давление реакции, увеличить конверсию сырья и получить больше целевого продукта.
В промышленности широко используются процессы химической синтеза, промышленные катализаторы находят применение во множестве отраслей. Например, в производстве аммиака используется катализатор на основе железа, который обеспечивает низкую температуру реакции и повышенную конверсию сырья. Процессы окисления на катализаторах используются в производстве кислорода, водорода, азотной кислоты и других веществ.
| Продукт | Реакция | Катализатор |
|---|---|---|
| Аммиак | N2 + 3H2 → 2NH3 | Железо |
| Кислород | 2H2O → 2H2 + O2 | Платина |
| Азотная кислота | 3H2 + N2O → 2H2O + 2NO | Платина-родий |
Знание скорости химических реакций позволяет также разработать эффективные схемы очистки отходов и утилизации опасных веществ, что является важной задачей экологически ответственного производства. Сокращение времени реакции позволяет снизить количество образующихся отходов и снизить негативное воздействие на окружающую среду.
Таким образом, понимание и контроль скорости химической реакции имеют важное практическое значение для промышленности. Это позволяет повысить эффективность процессов, снизить затраты и улучшить условия производства, а также сделать производство более экологически безопасным.
Скорость химической реакции и катализаторы
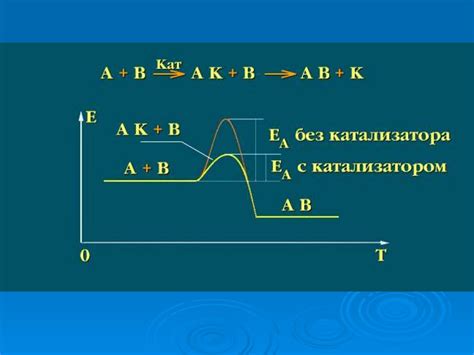
Одним из важных факторов, влияющих на скорость химической реакции, являются катализаторы. Катализаторы – это вещества, которые способны ускорять химическую реакцию, не изменяя себя в процессе. Они обладают специальной активностью и способны снижать энергию активации реакции, что позволяет ей протекать быстрее или при более низких температурах.
Катализаторы находят широкое применение в различных областях. Например, в промышленности катализаторы позволяют снизить затраты энергии на процессы синтеза, улучшить производительность и повысить качество продуктов. В лаборатории катализаторы используются для ускорения химических реакций и изучения особенностей различных процессов.
Существует два основных типа катализаторов: гомогенные и гетерогенные. Гомогенные катализаторы растворяются в реакционной среде и образуют с ней однородную систему. Гетерогенные катализаторы, наоборот, находятся в разделении с реакционной средой и взаимодействуют с ней только на поверхности.
- Примеры гомогенных катализаторов: кислоты и щелочи в растворах, комплексные соединения переходных металлов.
- Примеры гетерогенных катализаторов: металлы и их соединения, оксиды, силикаты и другие материалы с большой поверхностью.
Разработка и использование эффективных катализаторов является важной задачей современной науки. Ученые активно исследуют механизмы катализа и разрабатывают новые материалы с повышенной активностью и селективностью. Использование хорошо подобранных катализаторов может быть решающим фактором в успешном осуществлении химических превращений и создании новых веществ и материалов с желаемыми свойствами.
Скорость химической реакции и факторы, влияющие на нее
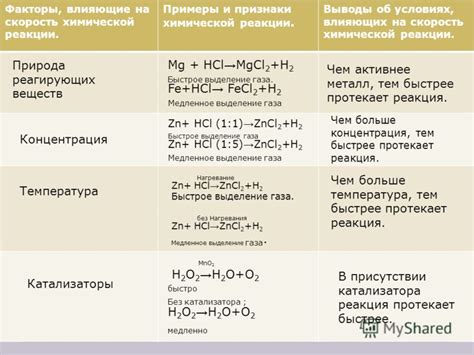
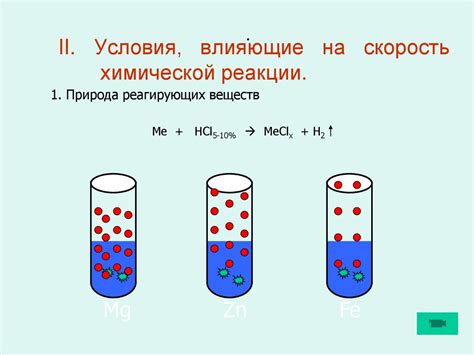
Скорость химической реакции зависит от множества факторов, которые могут быть разделены на две основные группы: влияние концентрации реагентов и воздействие физических условий.
| Факторы, влияющие на скорость химической реакции | Описание |
|---|---|
| Концентрация реагентов | Повышение концентрации реагентов увеличивает вероятность столкновений между частицами реагентов и, следовательно, увеличивает скорость реакции |
| Температура | Увеличение температуры повышает среднюю кинетическую энергию частиц, что приводит к увеличению скорости реакции |
| Поверхность реагента | Увеличение поверхности реагента (например, путем измельчения или использования катализаторов) увеличивает площадь контакта реагентов и, следовательно, повышает скорость реакции |
| Присутствие катализаторов | Катализаторы увеличивают скорость реакции, участвуя в промежуточных стадиях реакции, но при этом не расходуются и остаются неизменными к концу реакции |
Понимание и контроль скорости химических реакций позволяет улучшить эффективность процессов и создать новые продукты. Оно может быть использовано для разработки более эффективных катализаторов, оптимизации технологических процессов и создания новых материалов с уникальными свойствами.
Скорость химической реакции и ее измерение
Скорость реакции может быть измерена с помощью различных методов. Один из наиболее распространенных методов измерения - это определение изменения концентрации одного из реагентов или продуктов реакции с течением времени. Для этого проводятся эксперименты, в которых фиксируется концентрация вещества на разных этапах реакции.
Другой метод измерения скорости химической реакции - это использование изменения физических свойств системы, таких как изменение температуры или давления. Например, в некоторых реакциях сопровождающиеся образованием или потреблением газа можно измерить скорость реакции по изменению давления в реакционной системе.
Знание скорости реакции важно во многих областях науки и промышленности. Например, в фармацевтической промышленности знание скорости реакции позволяет оптимизировать процессы синтеза лекарственных веществ. В пищевой промышленности скорость реакции влияет на процессы переработки и консервирования продуктов. Знание скорости реакции также имеет большое значение в экологии для определения скорости окисления вредных веществ в атмосфере.
Важно отметить, что скорость реакции может изменяться в зависимости от различных факторов, таких как концентрация реагентов, температура, катализаторы и другие. Поэтому измерение скорости реакции является неотъемлемой частью исследования химических процессов и позволяет разработать эффективные и экономичные технологии производства.
Скорость химической реакции и безопасность
Быстрые и не контролируемые реакции могут привести к авариям, взрывам или выделению опасных паров. Знание скорости реакции позволяет определить оптимальные условия выполнения химического процесса и предпринять меры для предотвращения внезапных и нежелательных реакций.
Кроме того, знание скорости реакции позволяет проводить более точные расчеты в химической промышленности. Это помогает оптимизировать процессы производства, сократить затраты на реагенты и энергию, а также уменьшить отходы и вредные выбросы.
Для контроля скорости химических реакций используются различные методы, такие как изменение температуры, добавление катализаторов или регулирование соотношения реагентов. Эти методы позволяют изменять скорость процесса в нужном направлении, чтобы достичь требуемых результатов.
Пример | Выполнение химической реакции слишком быстро может привести к накоплению большого количества тепла. Это может вызвать повышение давления в реакторе и привести к его разрыву. Контроль скорости реакции и предварительный расчет условий позволяют избежать таких опасных ситуаций. |
Пример | В процессе производства определенного вещества может образоваться опасный побочный продукт. Путем изменения скорости реакции можно ускорить образование желаемого продукта и снизить образование опасного побочного продукта. |



