Внешний электронный слой – важное понятие в области химии, которое определяет химические свойства атомов и молекул. Внешний электронный слой состоит из электронов, находящихся на самом внешнем энергетическом уровне атома или молекулы. Именно эти электроны взаимодействуют с электронами других атомов, обуславливая возможность химической связи и образование соединений.
Количество электронов на внешнем слое атома или молекулы определяет его валентность и химические свойства. Обычно атом стремится иметь заполненный или полностью пустой внешний электронный слой, чтобы достигнуть наиболее стабильного состояния. Эта особенность часто определяет химическую активность атомов и их склонность формировать соединения с другими атомами. Таким образом, внешний электронный слой играет важную роль в химических реакциях и образовании вещества.
Примером является внешний электронный слой углерода, который находится на втором энергетическом уровне и содержит 4 электрона. Благодаря этому, углерод обладает четырехвалентностью и может образовывать четыре химические связи с другими атомами углерода или атомами других элементов. Эта способность делает углерод основным строительным блоком огромного количества органических соединений, включая жизненно важные молекулы, такие как углеводы, липиды, нуклеиновые кислоты и белки.
Внешний электронный слой в химии
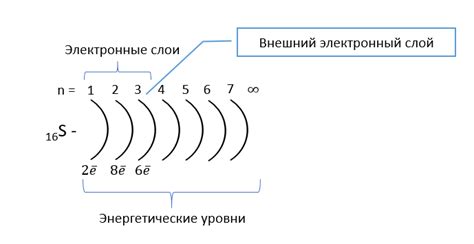
Внешний электронный слой в химии относится к последнему энергетическому уровню атома, который содержит электроны. Этот слой называется также валентным слоем, потому что он определяет химические свойства атома и его способность вступать в химические реакции.
Внешний электронный слой может содержать от одного до восьми электронов, в зависимости от номера группы, к которой относится атом. Всего имеется семь электронных слоев, обозначенных буквами от K до Q. Валентные электроны располагаются на самом последнем слое, что делает их наиболее доступными для участия в химических реакциях.
Число валентных электронов для атома можно определить по его группе в таблице Менделеева. Например, атомы из первой группы (группа щелочных металлов) имеют один валентный электрон, а атомы из восьмой группы (группа инертных газов) имеют восемь валентных электронов.
Валентные электроны играют ключевую роль в образовании химических связей между атомами. Атомы с неполным внешним электронным слоем стремятся заполнить его, чтобы достичь наиболее стабильного состояния. Для этого они могут участвовать в различных типах химических реакций, таких как образование ковалентных и ионных связей.
Знание числа валентных электронов атома позволяет определить его химические свойства и предсказать, какие соединения может образовать. Это полезно при изучении химических реакций, разработке новых материалов и прогнозировании поведения веществ в различных условиях.
Роль внешних электронных слоев в атомах
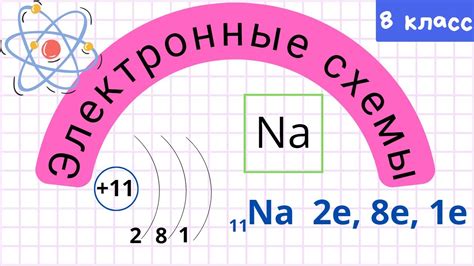
Внешний электронный слой, или валентная оболочка, играет важную роль в атомах. Она состоит из электронов, находящихся самыми дальними от ядра. Эти электроны называются валентными электронами и определяют химические свойства атома.
Валентные электроны в основном взаимодействуют с электронами других атомов при формировании химических связей. Именно благодаря взаимодействию внешних электронных слоев возникают все химические реакции и образуются соединения.
Количество валентных электронов в атоме зависит от его валентности. Валентность - это число, указывающее на сколько атом может образовывать связей с другими атомами. Атомы с полностью заполненным внешним электронным слоем имеют нулевую валентность и не образуют химических связей.
Понимание роли внешних электронных слоев в атомах позволяет предсказывать и объяснять химические свойства веществ, их реактивность и способность образовывать связи с другими атомами. Это является основой для разработки новых веществ, материалов и лекарств.
Принципы формирования внешнего электронного слоя
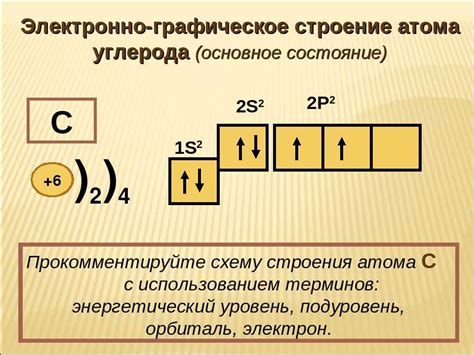
Внешний электронный слой атома формируется в соответствии с основными принципами электронного строения атомов:
- Принцип заполнения орбиталей по возрастанию энергии.
- Принцип включения Паули.
- Принцип Гунда.
Согласно этому принципу, электроны заполняют орбитали в порядке возрастания их энергии. Сначала заполняются орбитали с наименьшей энергией, а затем орбитали с более высокой энергией.
Согласно этому принципу, каждая орбиталь может быть заполнена максимум двумя электронами с противоположным спином.
Согласно этому принципу, орбитали одного уровня энергии заполняются по одной, прежде чем они начинают заполняться парами.
Эти принципы помогают понять, каким образом атомы формируют свои внешние электронные слои и определить их электронную конфигурацию. Внешний электронный слой является крайним слоем электронов и непосредственно влияет на химические свойства атома, так как эти электроны участвуют в химических реакциях.
Влияние внешнего электронного слоя на свойства вещества

Внешний электронный слой атома играет важную роль в определении свойств вещества. Эта область электронного облака содержит электроны, которые находятся на самом большом расстоянии от ядра и поэтому обладают наибольшей энергией. Эти электроны называют валентными электронами и отвечают за химическую активность элемента.
Количество валентных электронов определяет, какие химические связи может образовать атом. Атомы, имеющие полностью заполненный внешний электронный слой, обычно не образуют химических связей и являются инертными. Например, гелий имеет два электрона в своем внешнем электронном слое и, следовательно, не образует химических соединений, оставаясь стабильным.
Внешний электронный слой также определяет химические свойства элементов. Элементы с разным количеством валентных электронов будут обладать разными свойствами. Например, металлы, которые имеют немного валентных электронов, имеют способность образовывать положительные ионы, так как они готовы отдать свои электроны. Также, элементы, имеющие высокое количество валентных электронов, могут образовывать отрицательные ионы или сложные химические соединения с другими элементами.
Внешний электронный слой также определяет физические свойства вещества. Например, молекулы с валентными электронами, участвующими в образовании связей, могут иметь высокие температуры кипения и плавления из-за прочности внутримолекулярных связей.
Влияние внешнего электронного слоя на свойства вещества также проявляется в его реакционной способности. Элементы, имеющие несколько валентных электронов, могут образовывать различные химические соединения, что позволяет им проявлять множество химических реакций. Это явление называется полиморфизмом и важно для различных процессов, от экологии до материаловедения.
Применение знаний о внешнем электронном слое в химических реакциях

Внешний электронный слой атома играет ключевую роль в процессе химических реакций. Знание о расположении электронов на внешнем энергетическом уровне позволяет предсказать, какие атомы смогут образовывать связи друг с другом, и на основе этого прогнозировать возможность реакций.
Реакция между атомами включает обмен электронами и формирование химических связей. Атомы стремятся заполнить свой внешний электронный слой, чтобы достичь стабильной конфигурации электронов, а это осуществляется путем образования химических связей с другими атомами.
Знание о внешнем электронном слое атома позволяет предсказывать, какие элементы могут образовывать соединения с определенными химическими свойствами. Например, элементы с полностью заполненным внешним слоем (нобелевы газы) обычно очень мало реактивны, потому что они уже имеют стабильную конфигурацию электронов.
С другой стороны, элементы с неполностью заполненным внешним слоем, такие как щелочные и щелочноземельные металлы, стремятся образовать ионы, потеряв или получив электроны, чтобы достичь стабильной конфигурации. Это позволяет им образовывать ионные соединения с другими элементами.
Также знание о внешнем электронном слое помогает понять, как происходят химические реакции, такие как окислительно-восстановительные реакции. В этих реакциях происходит перемещение электронов между атомами. Атомы с неполностью заполненным внешним слоем могут стать окислителями, теряя электроны, в то время как атомы с полностью или почти полностью заполненным слоем могут стать восстановителями, получая электроны.
В целом, знание о внешнем электронном слое атома позволяет предсказывать типы реакций, которые элементы могут участвовать, и понимать, как происходят эти реакции. Это важное знание в области химии и позволяет исследователям и промышленности разрабатывать новые соединения и материалы, а также улучшать существующие процессы и продукты.
| Преимущества использования знаний о внешнем электронном слое: |
|---|
| 1. Предсказание возможности химических реакций. |
| 2. Понимание химических свойств элементов и соединений. |
| 3. Разработка новых соединений и материалов. |
| 4. Усовершенствование химических процессов и продуктов. |



