Атом углерода – один из самых распространенных и уникальных элементов в природе. Он играет важную роль в органической химии и является основой для образования огромного разнообразия соединений, от простейших до сложнейших органических веществ.
Одной из удивительных особенностей атома углерода является его способность образовывать четыре валентных связи с другими атомами. Это позволяет говорить о многовалентном характере углерода и его неограниченных возможностях соединения с другими элементами. Благодаря этим свойствам, углерод образует разнообразные структуры и формы, такие как цепи, кольца и трехмерные сетки, обеспечивая огромное разнообразие органических соединений и их уникальные свойства.
Сочетание возможностей атома углерода с его гибкостью и изменчивостью позволяет создавать бесконечное количество различных органических соединений. Например, валентные связи углерода с другими атомами могут быть прямыми, косыми или двойными, образуя сложные структуры и многообразие связей. Это приводит к возникновению разнообразных классов органических соединений, таких как углеводороды, аминокислоты, углеродные кислоты и даже ДНК.
Таким образом, атом углерода является одним из самых универсальных и важных элементов в природе, обладающим уникальными валентными возможностями. Понимание и объяснение этих возможностей позволяют углубить наши знания в области органической химии и создавать новые соединения с удивительными свойствами и приложениями в различных областях науки и технологий.
Формирование и свойства углеродных связей
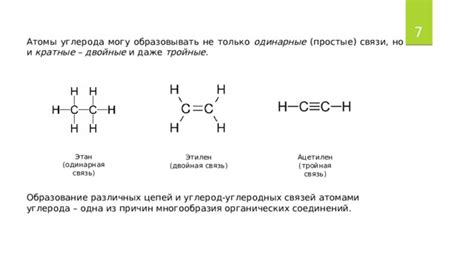
Углерод, как атом, обладает уникальной способностью образовывать множество различных химических связей. Однако особую роль в его химической активности играют его валентные электроны, которые определяют возможность образования связей.
В атоме углерода имеется четыре валентных электрона, что позволяет ему образовывать четыре связи с другими атомами. Однако, при формировании углеродных связей, есть два основных типа связей - σ (сигма) и π (пи).
Сигма-связь представляет собой прямую химическую связь между двумя атомами. Она образуется путем наложения двух орбиталей, каждая из которых прилегает к двум разным атомам вдоль оси связи. Сигма-связь обладает высокой степенью симметрии и является самой прочной и наиболее важной связью в органической химии.
Пи-связь образуется между двумя атомами через перекрывание плоских орбиталей. Она является второстепенной связью по сравнению с сигма-связью и наблюдается только при наличии σ-связи. Пи-связь обладает низкой степенью симметрии и может быть разорвана путем вращения атомов вокруг оси связи.
Углеродные связи могут быть одиночными, двойными и тройными, в зависимости от количества образованных связей между атомами. Одиночная связь состоит из сигма-связи. Двойная связь состоит из сигма-связи и одной пи-связи. Тройная связь состоит из сигма-связи и двух пи-связей.
Формирование и свойства углеродных связей играют важную роль в химии углерода и определяют его способность к образованию различных органических соединений.
Роль атома углерода в органической химии
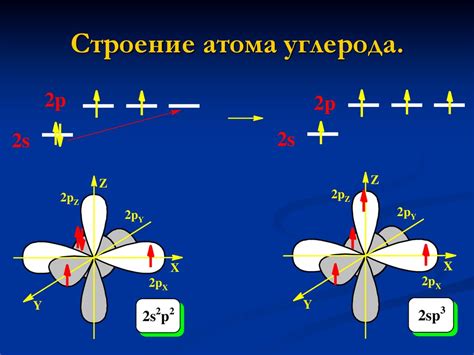
Атом углерода играет ключевую роль в органической химии, являясь основной основой для формирования огромного числа органических соединений. Его способность к образованию четырех ковалентных связей позволяет атому углерода создавать разнообразные структуры с помощью соседних атомов других элементов и самого себя.
Атом углерода может быть связан с другими атомами углерода, образуя различные углеродные цепи, которые являются основой для органических молекул. Углеродные цепи могут быть одноатомными (алканы), содержать двойные связи (алкены) или тройные связи (алкатины), а также быть разветвленными или циклическими.
Атом углерода также способен образовывать соединения со множеством других элементов, таких как водород, кислород, азот и многое другое. Это позволяет атому углерода образовывать различные функциональные группы, добавляя к органическим молекулам новые свойства и возможности для химических реакций.
Большое разнообразие органических соединений, как естественного, так и искусственного происхождения, основано на способности атома углерода создавать стабильные и разнообразные химические связи. Эта уникальная способность атома углерода делает его одним из самых важных элементов в органической химии и обеспечивает основу для изучения и понимания сложных органических структур и реакций.
Углеродные кластеры и нанотрубки
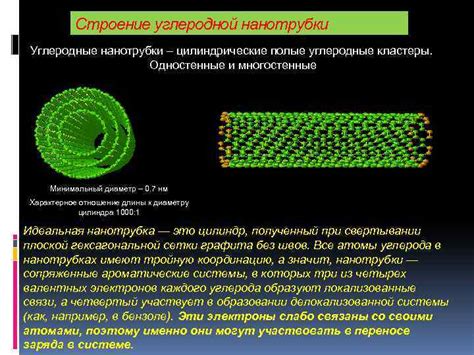
Атом углерода обладает особым свойством складываться в различные структуры, такие как углеродные кластеры и нанотрубки. Эти структуры имеют уникальные свойства и находят применение в различных областях науки и технологий.
Углеродные кластеры представляют собой совокупность атомов углерода, объединенных в небольшие частицы. Эти частицы могут иметь различную форму и размеры, в зависимости от условий синтеза. Углеродные кластеры активно изучаются с помощью различных экспериментальных и вычислительных методов.
Одной из наиболее известных структур углеродных кластеров является графен – двухмерный слой атомов углерода, соединенных в шестиугольные решетки. Графен обладает уникальными свойствами, такими как высокая прочность, электропроводность и термостабильность, что делает его привлекательным материалом для различных приложений.
Нанотрубки представляют собой круглые или цилиндрические структуры, состоящие из валентных атомов углерода. Они обладают уникальными свойствами, такими как большая прочность и электропроводность. Нанотрубки могут иметь различный диаметр и длину, что позволяет использовать их в различных областях, таких как электроника, медицина и материаловедение.
| Применения углеродных кластеров: | Применения нанотрубок: |
|---|---|
| • Катализаторы в химической промышленности | • Электронные компоненты, такие как транзисторы и солнечные батареи |
| • Материалы для суперконденсаторов | • Волокна для усиления материалов |
| • Маркеры в биомедицинских исследованиях | • Сенсоры для обнаружения различных веществ |
Углеродные связи и их роль в создании материалов

Одной из самых известных форм углерода является алмаз - самый твердый известный минерал. Алмаз состоит из трехмерной кристаллической решетки, построенной из углеродных атомов, каждый из которых связан с четырьмя другими атомами углерода. Эта кристаллическая структура придает алмазу его уникальные физические свойства.
Еще одной формой углерода является графит - материал, который используется, например, в карандашах. В графите углеродные атомы образуют слои, которые легко разделяются друг от друга, образуя мягкую и смазочную структуру. Графит обладает отличными электрическими свойствами и используется в производстве аккумуляторов и электродов.
Углерод также может образовывать связи с другими элементами, что позволяет создавать широкий спектр материалов с различными свойствами. Например, связь углерода с кремнием образует материал под названием кремнийкарбид (SiC), который обладает высокой твердостью и теплопроводностью, и используется в производстве керамики и полупроводниковых устройств.
Углеродные связи также играют важную роль в создании загадочных наноматериалов, таких как углеродные нанотрубки и графен. Углеродные нанотрубки обладают уникальными механическими и электрическими свойствами, и применяются в множестве отраслей, включая электронику, медицину и материаловедение. Графен, состоящий из одного слоя атомов углерода, имеет удивительные свойства, включая высокую прочность и электропроводность. Из-за своего потенциала в электронике и энергетике, графен считается одним из наиболее перспективных материалов будущего.
Атом углерода в биологических системах
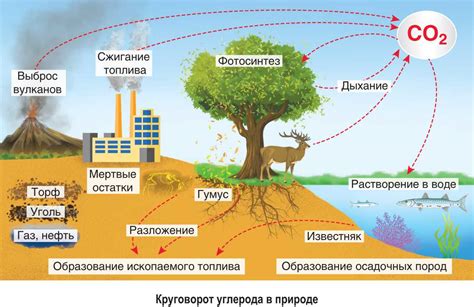
Одним из важных аспектов связанных с атомом углерода в биологии, является его способность образовывать четыре ковалентные связи. Эта особенность позволяет атому углерода демонстрировать большую степень химической разнообразности внутри различных молекул. Атомы углерода могут образовывать длинные цепочки и кольца, включающиеся в структуры белков, углеводов и липидов.
Еще одной важной ролью атома углерода в биологических системах является его участие в создании основных биомолекул, таких как ДНК и РНК. Углеродные каркасы этих молекул обеспечивают стойкую и надежную структуру, основанную на ковалентных связях между атомами углерода.
Кроме того, атом углерода играет важную роль в метаболических процессах, таких как дыхание и фотосинтез. В этих процессах, атомы углерода переносятся и превращаются от одной формы к другой, обеспечивая энергетическую поддержку клетке и организму в целом.
Будущие перспективы и применения углерода
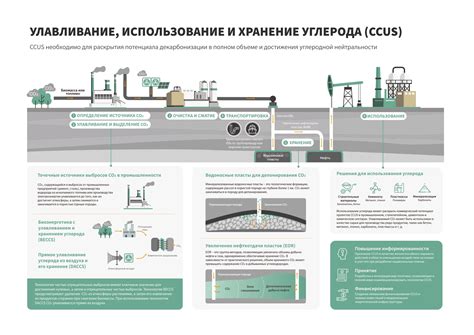
Одной из перспективных областей применения углерода является производство современных электродов для электрических аккумуляторов. Углеродные электроды обеспечивают высокую производительность и длительный срок службы аккумуляторов. Это позволяет разрабатывать более эффективные источники питания для различных устройств и транспортных средств, включая электромобили.
Еще одним интересным направлением развития использования углерода является создание наноматериалов. Углеродные наноматериалы обладают уникальными свойствами, такими как высокая прочность, проводимость и площадь поверхности. Они могут быть использованы в различных областях, включая электронику, катализ и медицину. К примеру, углеродные нанотрубки могут служить основой для создания новых видов композитных материалов, которые будут обладать высокой прочностью и легкостью.
Кроме того, углерод может быть использован в области альтернативной энергетики. Например, углеродные наноструктуры могут быть использованы для создания солнечных элементов, которые будут обладать высокой эффективностью преобразования солнечной энергии в электрическую. Такие элементы могут стать избыточными источниками чистой энергии, что поможет уменьшить зависимость от ископаемых ресурсов и уменьшить негативное влияние на окружающую среду.



