Валентность - это одно из важнейших понятий в химии, которое помогает определить способность атома образовывать химические связи с другими атомами. Валентность показывает количество электронов, которые может отдать или принять атом, чтобы достичь стабильной электронной конфигурации.
Валентность определяется основным (наиболее типичным) значением, которое обычно равно числу внешних электронов в атоме. Внешние электроны называются валентными электронами, и они имеют наибольшую роль в образовании химических связей и реакциях атомов. Валентность атома может быть положительной или отрицательной.
Валентность важна для понимания химической структуры вещества и его реакционной способности. Она помогает определить тип и количество связей, которые атом может образовать. Валентность обычно записывается в виде целых или десятичных чисел, которые указывают на число электронов, участвующих в образовании связи. Например, водород имеет валентность 1, кислород - 2, а азот - 3.
Валентность может быть изменена в процессе химической реакции, где атом может отдавать или принимать электроны от других атомов. Изменение валентности позволяет атомам образовывать различные виды химических связей и создавать разнообразные химические соединения.
Валентность в химии: понятие и основные принципы
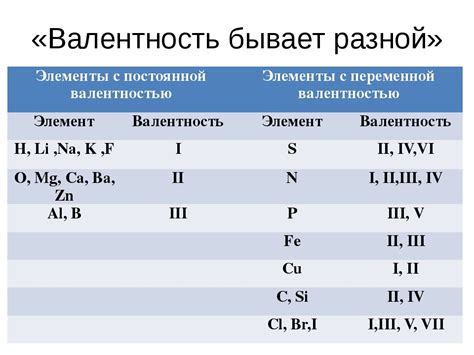
Выявление валентности элемента осуществляется на основе его электронной конфигурации. Конфигурация электронов внешнего энергетического уровня определяет, сколько электронов готово принять или отдать элемент при взаимодействии с другими атомами и молекулами. Валентность элемента может быть положительной или отрицательной в зависимости от того, сколько электронов он готов отдать или принять в процессе реакции.
Валентность, обычно, обозначается числом или знаком, написанным рядом с символом химического элемента. Например, валентность кислорода равна -2, поэтому он готов принять 2 электрона при реакции. Альтернативно, валентность атома натрия равна +1, что означает, что он готов отдать один электрон.
Основная принципы валентности заключаются в следующем:
- Валентность элемента является постоянной и специфичной характеристикой данного элемента.
- Валентность элементов сходной электронной конфигурации обычно одинаковая.
- Элементы с полностью заполненными электронными оболочками имеют нулевую валентность, так как они не могут взаимодействовать с другими атомами.
- Количество электронов, принимаемых или отдаваемых элементом в процессе реакции, определяется его степенью окисления.
Знание валентности элементов позволяет установить возможные реакции и построить грамотные химические уравнения. Валентность важна для понимания свойств химических соединений и их взаимодействия. Она играет ключевую роль в изучении реакций, составлении химических формул и определении степени окисления элементов.
Что такое валентность в химии?
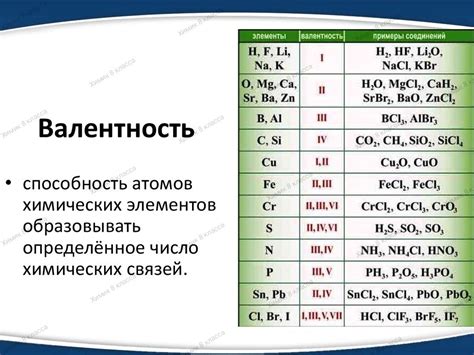
Различные элементы имеют разную валентность, которая может быть положительной или отрицательной. Положительная валентность указывает на способность атома отдавать электроны, образуя ион с положительным зарядом, называемым катионом. Отрицательная валентность указывает на способность атома принимать электроны, образуя ион с отрицательным зарядом, называемым анионом.
Валентность атома зависит от его электронной конфигурации, то есть расположения электронов в его энергетических оболочках. Наибольший вклад в валентность вносит внешний электронный слой, называемый валентной оболочкой. Число электронов в валентной оболочке определяет максимальную валентность атома.
Валентность используется для определения формирования химических соединений, таких как молекулы и кристаллические решетки. Валентность атома указывает на его возможную связность и нейтральные или заряженные состояния, которые могут быть образованы при образовании связей. Например, кислород имеет валентность -2, поэтому образует двухвалентные отрицательные ионы при образовании соединений.
Как определяется валентность?
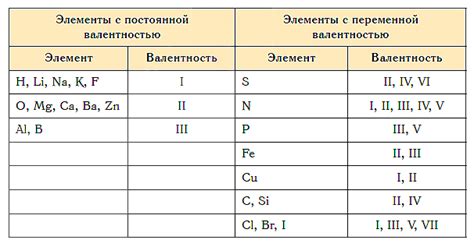
Определение валентности основывается на расположении элемента в периодической системе химических элементов. Для определения валентности атома, обратите внимание на его положение в периоде и группе:
1. Определение валентности по группе:
Валентность атома соответствует номеру главной группы (группы, обозначенной цифрой) в периодической системе. Например, элементы группы 1 имеют валентность 1, элементы группы 2 имеют валентность 2, и так далее.
2. Определение валентности по периоду:
Чаще всего валентность элемента равна 8 минус номер последнего периода, в котором он находится. Например, элементы последнего периода (восьмого) имеют валентность 0, элементы седьмого периода имеют валентность 1 и так далее.
Однако стоит отметить, что валентность элемента может быть изменена в результате образования ионов или сложных соединений. В некоторых случаях, валентность может быть определена на основе зарядов ионов или степени окисления вхождения элемента в химическое соединение.
Знание валентности элементов позволяет предсказывать их возможности для образования химических связей, что является важным для понимания и анализа реакций и образования химических соединений.
Принципы определения валентности

1. Расчет на основе электронной конфигурации: Электронная конфигурация атома позволяет определить количество электронов в валентной оболочке и следовательно, валентность элемента. Например, у кислорода валентная оболочка содержит 6 электронов, поэтому его валентность равна -2.
2. Расчет на основе химических связей: Валентность может быть определена через химические реакции и образование химических связей. Например, атом натрия имеет 1 электрон в валентной оболочке и может отдать его, образовав ион Na+, поэтому валентность натрия равна +1.
3. Расчет на основе окислительного числа: Окислительное число элемента - это степень его окисления или восстановления в соединении. Окислительное число помогает определить валентность элемента. Например, окислительное число атома кислорода в молекуле воды H2O равно -2, следовательно, валентность кислорода равна -2.
Определение валентности является важным инструментом для изучения химических свойств элементов и их взаимодействий. С точки зрения формул химических соединений, валентность позволяет определить необходимое количество атомов разных элементов для образования стабильного соединения.
Значение валентности в химических взаимодействиях
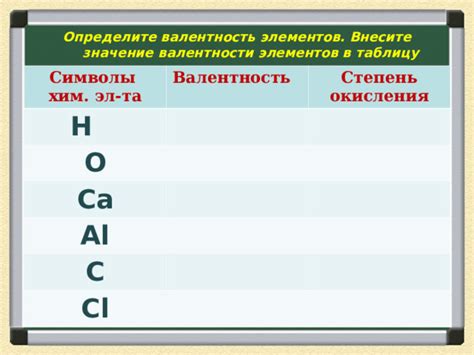
Валентность в химии играет ключевую роль в определении возможности и характера химических взаимодействий. Она представляет собой способность атома или группы атомов принять, отдать или разделить электроны при образовании химических связей.
Зная валентность элементов, можно предсказать, какие вещества они могут образовывать при соединении с другими элементами. Атомы стремятся достичь электронной конфигурации инертных газов (восемь электронов в внешней электронной оболочке), поэтому они образуют связи, чтобы стать электронной конфигурации инертного газа.
Валентность химического элемента указывает на число связей, которые атом может образовать. Например, кислород имеет валентность -2, это означает, что он может принять два электрона, чтобы достичь стабильной электронной конфигурации. Водород имеет валентность +1, поэтому он может отдать один электрон, чтобы образовать связь с другим элементом.
Значение валентности также влияет на тип химической связи между атомами. Если элемент имеет положительную валентность, он будет образовывать ионные связи, передавая электроны другому элементу. Если элемент имеет отрицательную валентность, он будет образовывать ковалентные связи, разделяя электроны с другим элементом.
Валентность элементов может изменяться в разных соединениях, и это зависит от количества электронов во внешней электронной оболочке и расположения элемента в периодической системе. Изучение валентности помогает химикам прогнозировать свойства и реакции веществ, а также создавать новые соединения и материалы для различных промышленных и научных целей.
Примеры валентности в химических соединениях:
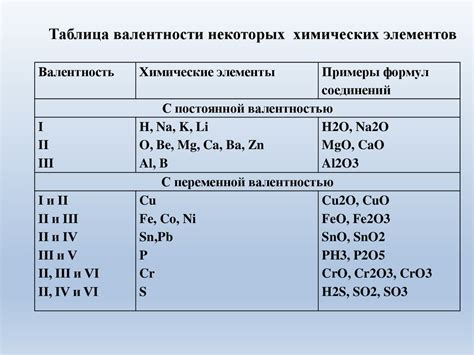
Валентность элемента определяет количество связей, которые оно может образовать с другими элементами. Рассмотрим несколько примеров валентности в химических соединениях:
- Вода (H2O): валентность кислорода равна 2, так как он образует две связи с водородом, каждый из которых имеет валентность 1.
- Аммиак (NH3): валентность азота равна 3, так как он образует три связи с водородом, каждый из которых имеет валентность 1.
- Углеродаты (например, метан CH4 и этан C2H6): валентность углерода равна 4, так как он образует четыре связи с водородом, каждый из которых имеет валентность 1.
- Хлорид натрия (NaCl): валентность натрия равна 1, так как он образует одну связь с хлором, который имеет валентность 1.
- Оксид углерода (CO2): валентность кислорода равна 2, так как он образует две связи с углеродом, который имеет валентность 4.
- Сера в серноводороде (H2S): валентность серы равна 2, так как она образует две связи с водородом, который имеет валентность 1.
Это лишь несколько примеров, и валентность элементов может меняться в зависимости от конкретного вещества и его реакционных условий.



