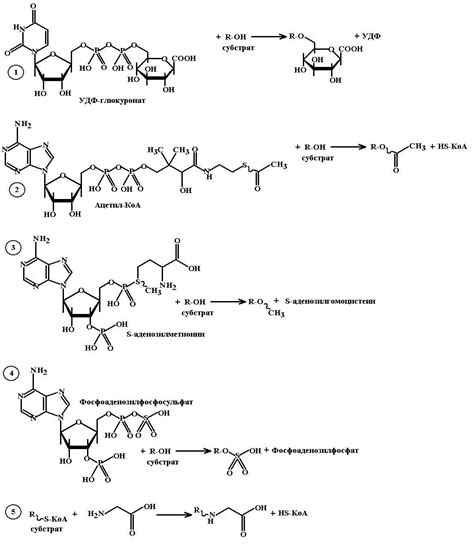
Реакции – это процессы, которые происходят между веществами и приводят к образованию новых веществ. Они являются основой всех химических превращений и явлений. Реакции могут происходить как в одной фазе (гомогенные), так и между веществами разных фаз (гетерогенные). Различие между этими типами реакций заключается в состоянии веществ, участвующих в процессе.
Гомогенные реакции – это процессы, в которых реагенты и продукты находятся в одной и той же фазе. В таких реакциях все вещества имеют одинаковую структуру и одинаковые физические свойства. Например, растворы, газы или жидкости могут быть гомогенными средами для химических реакций. Главное отличие гомогенных реакций заключается в том, что они происходят равномерно, без видимой разделения фаз.
Примером гомогенной реакции может служить растворение соли в воде. Здесь соль и вода находятся в одной фазе – оба вещества являются жидкими. Процесс растворения происходит равномерно, и реакция является гомогенной.
Гетерогенные реакции – это процессы, в которых вещества, участвующие в реакции, находятся в разных фазах. В таких реакциях реагенты и/или продукты имеют отличное от других веществ состояние. Например, реакции между жидкостью и газом, твердым телом и газом являются гетерогенными реакциями. Отличительной особенностью гетерогенных реакций является их неравномерность и видимое разделение фаз. В таких реакциях обычно наблюдаются разделительные поверхности между веществами.
На примере реакции между твердым кусочком цинка и кислотой можно наблюдать явное разделение фаз. Цинк – твердое тело, а кислота – жидкость. Эти две фазы существуют независимо друг от друга и контактируют лишь на поверхности раздела.
Гомогенные реакции

В гомогенных реакциях все реагенты находятся в одной фазе и равномерно распределены по объему. Например, растворение соли в воде, горение газа в воздухе, окисление железа в кислороде - все это примеры гомогенных химических реакций.
Одной из особенностей гомогенных реакций является то, что они происходят с достаточно высокой скоростью, поскольку все реагирующие частицы находятся
вблизи друг от друга и могут эффективно сталкиваться друг с другом.
Гомогенные реакции широко применяются в промышленности и научных исследованиях. Их механизмы изучаются для разработки новых катализаторов, понимания процессов в органическом синтезе и оптимизации производственных процессов.
Важно отметить, что гомогенные реакции могут быть не только химическими, но и физическими. Например, растворение сахара в воде или смешивание двух жидкостей, обладающих схожими химическими свойствами.
Изучение гомогенных реакций позволяет углубить наше понимание основных законов химии и применить их для разнообразных практических задач и научных исследований.
Определение и примеры

Примером гомогенной реакции может служить горение бензина. В этом случае, реагенты (бензин и кислород) находятся в одной фазе (газообразной) и равномерно смешиваются перед воспламенением.
Одним из типичных примеров гомогенных реакций является реакция образования растворов, таких как соль в воде или сахар в чае. В обоих случаях, соль и сахар полностью растворяются в воде, образуя однородную жидкость без видимых частиц реагентов.
Гетерогенные реакции - это реакции, в которых реагенты находятся в разных физических состояниях или не гомогенно распределены. В таких реакциях различные фазы реагентов отчетливо различимы и не образуют однородной системы.
Пример гетерогенной реакции может быть химическое осаждение. Например, при смешении растворов серебряного нитрата и хлорида натрия происходит образование белого осадка, который может быть видимым глазом.
Другой пример гетерогенной реакции - поверхностный катализ. В этом случае, реакционные молекулы адсорбируются на поверхность катализатора и взаимодействуют между собой.
Гетерогенные реакции

Примером гетерогенной реакции может служить реакция между газообразным кислородом и твердым углеродом при высокой температуре, что приводит к образованию угарного газа:
| Реагенты | Продукты |
|---|---|
| 2CO2 | 4CO + О2 |
В данном примере кислород в газообразном состоянии взаимодействует с твердым углеродом, превращая его в газообразный угарный газ. Такие реакции часто происходят на поверхности твердых веществ, где реакционная активность определяется доступностью мест для реакции или поверхностными свойствами.
Гетерогенные реакции имеют огромное значение во многих промышленных процессах, таких как гидрометаллургические процессы, каталитическое превращение веществ и синтез полимеров. Важно отметить, что различные фазы реагентов могут оказывать значительное влияние на кинетику и механизм реакции, поэтому понимание гетерогенных реакций является важным аспектом изучения химии.
Определение и примеры

Пример гомогенной реакции: растворение соли в воде. В данном случае исходные компоненты (соль и вода) находятся в одной фазе – жидкости, и в процессе реакции образуется растворенная вещество.
Гетерогенные реакции, напротив, происходят между компонентами, находящимися в разных фазах (например, жидкость и твердое вещество или газ и твердое вещество). В таких реакциях взаимодействие между компонентами может происходить на поверхности раздела фаз, и это влияет на характер реакции.
Пример гетерогенной реакции: сгорание древесины. В данном случае исходные компоненты (древесина и кислород) находятся в разных фазах – твердом и газообразном состояниях, соответственно, и реакция происходит на поверхности древесины.
Различия в скорости реакций
В гомогенных реакциях все реагенты находятся в одной фазе, поэтому их молекулы могут диффундировать и сталкиваться в процессе реакции. Это, в свою очередь, приводит к более равномерному распределению энергии и большей вероятности столкновений между молекулами. Благодаря этому гомогенные реакции обычно протекают с более высокой скоростью.
С другой стороны, в гетерогенных реакциях реагенты находятся в разных фазах. Например, реагенты могут быть в жидкой и газообразной фазах. Такое разделение фаз приводит к трудностям в диффузии и столкновении молекул. Молекулы реагентов должны преодолевать барьеры, созданные разделением фаз, что затрудняет процесс реакции. Из-за этого гетерогенные реакции обычно протекают с более низкой скоростью по сравнению с гомогенными реакциями.
Однако, степень различия в скорости реакций между гомогенными и гетерогенными системами может быть варьирующей и зависит от конкретной реакции и условий протекания процесса.
Влияние на химическую кинетику

Химическая кинетика изучает скорость химических реакций и факторы, которые на нее влияют. Реакции могут протекать различными способами, и их скорость может меняться в зависимости от условий. Гомогенные и гетерогенные реакции имеют различные факторы, влияющие на их химическую кинетику.
Гомогенные реакции
В гомогенных реакциях все реагенты находятся в одной фазе, что создает однородную среду. Важными факторами, влияющими на скорость гомогенной реакции, являются:
- Концентрация: Чем выше концентрация реагентов, тем выше скорость реакции. Это связано с тем, что больше молекул реагентов принимают участие в столкновениях и образовании новых соединений.
- Температура: Повышение температуры увеличивает скорость реакции, так как направление столкновений молекул изменяется и их энергия становится выше, что способствует образованию более активных комплексов.
- Поверхность: Если реагенты находятся в разных фазах, то их контактная поверхность играет роль. Чем больше площадь контакта между фазами, тем выше скорость реакции.
- Катализаторы: Некоторые вещества, называемые катализаторами, способны ускорять реакцию, не участвуя в ней химически. Они понижают энергию активации и облегчают путь реакции, что приводит к увеличению скорости.
Гетерогенные реакции
Гетерогенные реакции происходят между реагентами, находящимися в разных фазах (например, жидкость и газ, твердое тело и газ). Они обладают другими факторами, влияющими на их химическую кинетику:
- Концентрация: Концентрация реагентов в этом случае влияет на их диффузию и наличие поверхности контакта. Чем выше концентрация, тем больше возможностей для столкновений и образования новых соединений.
- Поверхность: Поверхность твердого тела может быть покрыта активными центрами, что способствует химическим реакциям. Чем больше поверхность, тем больше молекул реагентов может принять участие в реакции.
- Температура: Температура все еще играет роль в гетерогенных реакциях, поскольку повышение ее приводит к увеличению энергии активации и столкновений молекул.
- Катализаторы: Катализаторы также могут использоваться в гетерогенных реакциях для ускорения процесса. Они облегчают столкновения реагентов и повышают эффективность реакции.
Изучение гомогенных и гетерогенных реакций, а также их химической кинетики, помогает улучшить понимание протекания химических процессов и их оптимизации на практике.
Эффект поверхности

Когда реакция происходит на поверхности твёрдого тела или взаимодействует с границей раздела фаз, процессы могут протекать по-разному. Из-за дополнительной площади, предоставленной поверхностью, реакция может протекать быстрее (повышенная скорость) или иметь иные характеристики. Этот эффект известен как эффект поверхности.
Другой аспект эффекта поверхности - адсорбция. При адсорбции молекулы одного вещества могут присоединяться к поверхности другого вещества и образовывать адсорбционный слой. Это может сказываться на скорости реакции и её механизме.
| Пример гетерогенной реакции с эффектом поверхности: |
|---|
| Реакция окисления металла на воздухе |
| Реакция каталитического гидрирования |
Взаимодействие с гетерогенными катализаторами
Главное преимущество гетерогенных катализаторов заключается в том, что они могут быть использованы в реакциях, в которых реагенты находятся в разных фазах. Например, катализатор может находиться в твердой фазе, а реагенты – в газообразной или жидкой.
Процесс взаимодействия с гетерогенным катализатором начинается с адсорбции реагентов на его поверхности. Это происходит благодаря наличию активных центров, которые способны притягивать и удерживать молекулы реагентов.
Однако адсорбция не является окончательным этапом взаимодействия. Затем происходит реакция внутри катализатора, в результате чего образуется продукт или промежуточное соединение.
Гетерогенные катализаторы обладают существенными преимуществами, такими как возможность повторного использования, увеличение температуры реакции и улучшение селективности определенного продукта. Они также позволяют проводить реакции при более низких температурах и давлениях, что снижает энергозатраты.
Таким образом, гетерогенные катализаторы играют важную роль в различных процессах, включая производство химических веществ, очистку отходов и даже в биологических системах.



