Углекислый газ, также известный как СО2, является одним из самых распространенных газов в атмосфере Земли. Он образуется в результате множества химических реакций, особенно в результате горения и дыхания.
Этот газ играет важную роль в биохимии и экологии. Он является одним из главных газов, отвечающих за парниковый эффект, который приводит к глобальному потеплению и изменению климата. Углекислый газ также необходим для фотосинтеза растений, которые поглощают СО2 и выделяют кислород.
Углекислый газ проявляет активность в химических реакциях. Он может растворяться в воде, образуя карбоновую кислоту, что делает воду кислотной. Это одна из причин, почему океаны становятся все более кислыми из-за увеличения концентрации СО2 в атмосфере.
Кроме того, углекислый газ может претерпевать различные химические реакции, включая окислительно-восстановительные реакции. Например, он может реагировать с водородом, образуя метан и воду. Углекислый газ также может взаимодействовать с металлами, образуя карбонаты или бикарбонаты.
Углекислый газ и его свойства
Углекислый газ имеет несколько важных свойств, которые делают его значимым в различных областях науки и промышленности. Вот некоторые из них:
Растворимость: Углекислый газ хорошо растворяется в воде, образуя угольную кислоту. Это позволяет использовать его в различных процессах, включая производство газированных напитков и углекислого льда.
Реактивность: Углекислый газ является слабым кислотным оксидом и может образовывать кислоты во время химических реакций. Это свойство делает его полезным во многих промышленных процессах, например, для регулирования pH в жидкостях или для использования в огнетушителях.
Теплоемкость: Углекислый газ обладает высокой теплоемкостью, что означает, что он может поглощать и сохранять большое количество тепла. Это свойство позволяет использовать его в различных системах охлаждения, таких как холодильники и кондиционеры.
Требуемые условия для жизни растений: Углекислый газ является основным источником углерода для растений в процессе фотосинтеза. Растения преобразуют его в органические вещества с помощью солнечной энергии. Без углекислого газа растения не могут выжить.
Эти свойства углекислого газа позволяют применять его в широком спектре областей, от промышленности до сельского хозяйства, и делают его важным компонентом нашей природной среды.
Характеристики и основные свойства
Углекислый газ обладает рядом характеристик и свойств, которые делают его уникальным и важным для многих процессов:
- Растворимость: Углекислый газ хорошо растворяется в воде, что позволяет ему играть ключевую роль в геохимических циклах и биологических процессах.
- Кислотность: Углекислый газ образуется при растворении углеродного диоксида в воде, что приводит к образованию угольной кислоты. Эта свойство делает его важным игроком в управлении кислотно-щелочным балансом в природных и промышленных системах.
- Теплопроводность: Углекислый газ обладает хорошей теплопроводностью, что означает, что он эффективно передает тепло во время реакций, в которых участвует.
- Плотность: Углекислый газ тяжелее воздуха, поэтому он скапливается в низких областях, что может приводить к опасным ситуациям в закрытых помещениях или шахтах. Это также играет роль в глобальном потоке углерода и изменении климата.
- Воспламеняемость: Углекислый газ сам по себе не горюч, однако он может способствовать горению других веществ, например, углеводородов.
Это лишь некоторые из основных характеристик и свойств углекислого газа, которые определяют его роль в природных и промышленных процессах. Обладая такими уникальными свойствами, углекислый газ влияет на различные аспекты нашей жизни и окружающей среды.
Формирование углекислого газа
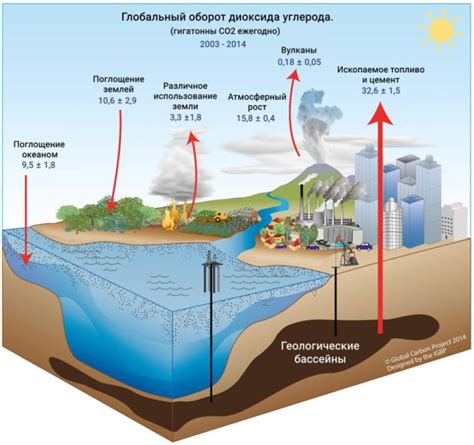
Естественный процесс образования углекислого газа называется дыханием растений и животных. В процессе дыхания организмы выделяют СO2 в окружающую среду. Естественно образующийся СO2 также поступает в атмосферу через вулканическую деятельность и геологические процессы.
Основным антропогенным источником углекислого газа является сжигание ископаемых топлив, таких как уголь, нефть и природный газ. В результате сгорания этих топлив выделяется большое количество СO2. Другим источником антропогенного СO2 является выработка в процессе промышленного производства.
Углекислый газ оказывает значительное влияние на климатические изменения и является главным газом, способствующим эффекту парникового газа в атмосфере Земли. Повышение концентрации СO2 в атмосфере ведет к увеличению температуры планеты и различным климатическим изменениям, таким как глобальное потепление и изменения в распределении осадков.
Роль углекислого газа в окружающей среде

Углекислый газ играет ключевую роль в процессе фотосинтеза, который осуществляется растениями. При фотосинтезе растения поглощают углекислый газ из атмосферы и превращают его в органические соединения, такие как углеводы и кислород. Это позволяет растениям расти и развиваться, а также выпускает кислород обратно в атмосферу для живых существ, включая людей и животных.
Углекислый газ также является одним из основных газов, вызывающих эффект парникового газа. В атмосфере он действует как "одеяло", задерживая тепло, излучаемое Землей, и предотвращая его уход в космос. Этот эффект приводит к глобальному потеплению и изменению климата на Земле. Проблема глобального потепления вызывает обеспокоенность среди ученых и требует принятия мер по снижению выбросов углекислого газа.
Большое количество углекислого газа также растворяется в водах океанов. Это важно для поддержания рН водной среды и баланса кислорода. Однако увеличение концентрации углекислого газа в атмосфере может влиять на морскую экосистему и приводить к кислотности океанов. Это может иметь серьезные последствия для жизни в морях и океанах, включая разрушение коралловых рифов и угрозу многим видам морской жизни.
Таким образом, роль углекислого газа в окружающей среде весьма значительна и важна для поддержания жизни на Земле. Но также необходимо контролировать его выбросы и применять меры для минимизации его негативного влияния на окружающую среду и климат.
Химические реакции с участием углекислого газа

Углекислый газ может быть вовлечен в различные химические реакции. Например, он может реагировать с водой и образовывать угольную кислоту (H2CO3), которая может быть дальше разложена на ионы водорода и карбонатные ионы:
CO2 + H2O → H2CO3
H2CO3 → H+ + HCO3-
Углекислый газ также может реагировать с щелочами, образуя соли угольной кислоты. Например, при реакции с гидроксидом натрия (NaOH) образуется карбонат натрия (Na2CO3):
CO2 + 2NaOH → Na2CO3 + H2O
Углекислый газ также может вступать в реакции с некоторыми металлами, образуя карбонаты или бикарбонаты. Например, сухой углекислый газ может реагировать с кальцием, образуя карбонат кальция (CaCO3):
CO2 + CaO → CaCO3
Кроме того, углекислый газ может быть использован в различных органических синтезах. Например, он может быть использован в качестве источника углерода при синтезе органических соединений.
Таким образом, углекислый газ находит широкое применение в химических реакциях, играя важную роль в различных процессах и синтезе органических соединений.
Использование углекислого газа в промышленности и быту

В промышленности углекислый газ используется в качестве охлаждающего и растворяющего вещества. Он является неотъемлемой частью процессов газификации, например, в производстве газообразных смесей для сварки и резки металла. Также, углекислый газ применяется при изготовлении безалкогольных напитков, где он обеспечивает натуральную газировку.
Бытовое применение углекислого газа нашло свое применение в современных технологиях, особенно в сфере бытовой холодильной техники. Углекислый газ используется как охлаждающая среда в холодильниках и кондиционерах, гарантируя их эффективную работу.
Также, углекислый газ нашел применение в системах пожаротушения, где его использование обусловлено его инертностью – его наличие в атмосфере помогает предотвратить возникновение и распространение огня. Это особенно важно для объектов с повышенной опасностью, таких как производственные цехи, склады, банки и т.д.
Таким образом, углекислый газ – универсальное вещество, демонстрирующее свою полезность и в промышленных процессах, и в повседневной жизни. Его применение основано на его уникальных физических и химических свойствах, позволяющих широко использовать его в различных сферах деятельности.



