CuO - это необычное соединение, которое вызывает некоторые затруднения в его классификации. При анализе его химической структуры и свойств становится очевидным, что оно не является ни кислотой, ни солью в стандартном понимании этих терминов.
Во-первых, для того чтобы определить CuO как кислоту или соль, необходимо понять его функциональную группу. Однако, известно, что кислоты обычно содержат гидроксильную группу (OH), а соли созданы через реакцию кислот с основаниями. В случае CuO, мы не видим гидроксильной группы, поэтому нельзя назвать его кислотой в стандартном смысле этого слова.
Также следует отметить, что CuO не образуется путем реакции кислоты и основания, поэтому его невозможно классифицировать как соль. Соли образуются путем передачи протона (водорода) от кислоты к основанию, образуя ионные связи. В случае CuO, мы имеем ионическую связь между ионами меди (Cu) и кислорода (O), что делает его необычным в контексте кислотных или сольных классификаций.
Конечно, может быть удобнее определить CuO в контексте его конкретных химических и физических свойств, а не пытаться поместить его в рамки классификации кислот или солей. Изучение его использования и реакций может помочь нам понять его роль и применимость в различных областях химии и технологии.
Кислотность CuO: реакции и свойства

Тем не менее, у CuO есть ряд реакций и свойств, которые обусловлены его основной природой. Прежде всего, оно может реагировать с кислотами, такими как кислота серной, образуя соответствующие соли. Например, когда CuO реагирует с серной кислотой (H2SO4), образуется сульфат меди (II) (CuSO4) и вода (H2O).
Также CuO может реагировать с кислородными кислотами, ионами аммония и некоторыми неорганическими основаниями. Например, солянокислота (HCl) реагирует с CuO, образуя хлорид меди (II) (CuCl2) и воду. Такие реакции свидетельствуют о щелочных свойствах CuO.
Кроме реакций с кислотами, CuO обладает свойствами, характерными для основных оксидов. Он способен реагировать с водой, образуя оксид меди (II) гидрата (Cu(OH)2). Также CuO может образовывать соли с кислотными оксидами, например, с угольной кислотой (H2CO3).
Основные оксиды, такие как CuO, могут также реагировать с кислородом при нагревании и образовывать пероксиды металла. Например, при нагревании CuO с кислородом образуется оксид меди (I) (Cu2O), а не пероксид.
Таким образом, хотя CuO не является кислотой и не обладает кислотными свойствами, его основная природа обусловливает ряд химических реакций и свойств, которые могут быть важными для его применения в различных областях.
Определение CuO как кислоты или соли

Кислоты - это вещества, которые обладают кислотными свойствами и могут отдавать водородные ионы (H+) в водном растворе. Обычно они образуются при реакции некоторых соединений с водой. Как правило, кислота содержит в своей формуле гидроксидную (OH-) или оксидную (O2-) группы. Некоторые известные кислоты - серная кислота (H2SO4), соляная кислота (HCl) и уксусная кислота (CH3COOH).
Соли - это соединения, которые образуются при реакции кислоты с основанием. Они состоят из металлического катиона (положительно заряженного иона) и аниона (отрицательно заряженного иона). Соли могут быть ионными или молекулярными соединениями. Ионные соли, как правило, имеют кристаллическую структуру и растворяются в воде, образуя электролитические растворы. Некоторые известные соли - хлорид натрия (NaCl), нитрат калия (KNO3) и карбонат кальция (CaCO3).
Относительно CuO, его можно определить как оксид, который образует с гидроксидом меди (II) (CuOH) растворимую в воде соль, CuOH+ кислота, HX (где H+ и X- могут быть различными ионами). Иными словами, CuO не является ни кислотой, ни солью в обычном понимании этих терминов.
Таким образом, CuO не является ни кислотой, ни солью, но является важным химическим соединением с другими свойствами и приложениями.
Реакции CuO с кислотами и основаниями

С кислотами CuO реагирует следующим образом:
- С соляной кислотой (HCl) образуется хлорид меди(II) (CuCl2) и вода (H2O).
- С серной кислотой (H2SO4) образуется сульфат меди(II) (CuSO4) и вода (H2O).
- С азотной кислотой (HNO3) образуется нитрат меди(II) (Cu(NO3)2) и вода (H2O).
В реакциях CuO с основаниями образуются соединения, которые обладают основными свойствами:
- С гидроксидом натрия (NaOH) образуется гидроксид меди(II) (Cu(OH)2) и натриевая соль (Na2O).
- С гидроксидом аммония (NH4OH) образуется гидроксид меди(II) (Cu(OH)2) и аммиак (NH3).
- С гидроксидом калия (KOH) образуется гидроксид меди(II) (Cu(OH)2) и калиевая соль (K2O).
Таким образом, CuO не является ни кислотой, ни солью, но может образовывать соединения с кислотами и основаниями в результате химических реакций.
Физические и химические свойства CuO
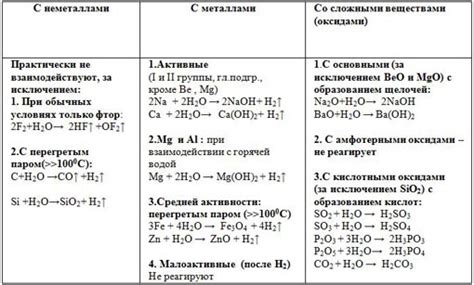
CuO (оксид меди) представляет собой химическое соединение, которое имеет следующие физические и химические свойства:
Физические свойства:
1. Цвет: CuO обычно имеет чёрный цвет с металлическим блеском.
2. Запах: CuO обычно не имеет запаха.
3. Твёрдость: CuO является твёрдым веществом.
4. Температура плавления: CuO плавится при высоких температурах - примерно при 1326 °C.
5. Вязкость: У CuO нет вязкости, так как оно является твёрдым веществом.
Химические свойства:
1. Реакция с водой: CuO не реагирует с водой при нормальных условиях.
2. Реакция с кислотами: CuO растворяется в различных кислотах, например, в серной кислоте, образуя соли.
3. Реакция с основаниями: CuO реагирует с основаниями, образуя соли и воду.
4. Окислительные свойства: CuO обладает окислительными свойствами и может окислять различные вещества.
5. Реакция с аммиаком: CuO реагирует с аммиаком и образует соль меди и воду.



