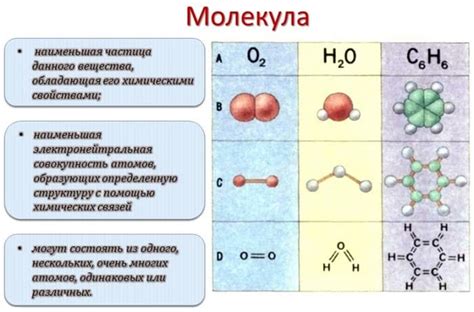
В мире химии и физики существуют различные виды молекул, одним из самых простых являются двухатомные молекулы. Их особенность заключается в том, что они состоят всего из двух атомов, соединенных между собой химической связью. Эти молекулы имеют свои особенности в строении, свойствах и значениях, которые играют важную роль в химических и физических процессах.
В строении двухатомных молекул каждый атом может быть разного вида, что вносит разнообразие в их характеристики. Например, молекула воды состоит из двух атомов водорода и одного атома кислорода, что придает ей уникальные свойства. Важно отметить, что положение атомов в молекуле также имеет значение – оно определяет форму молекулы, ее полярность и возможность взаимодействия с другими молекулами.
Двухатомные молекулы имеют большое значение в химии и физике. Они участвуют во множестве реакций и процессов, определяя их характер и результаты. Некоторые двухатомные молекулы являются важными для жизнедеятельности организмов – кислород и азот, например, необходимы для поддержания жизни на Земле.
Молекулы и их значение в химии
Молекулы имеют огромное значение в химии. Они играют роль в различных химических реакциях, обладают определенными физическими и химическими свойствами, и являются основными объектами изучения в химических исследованиях.
Молекулы могут быть органическими или неорганическими. Органические молекулы содержат углерод и главным образом изучаются в области органической химии. Неорганические молекулы, такие как соли и металлсодержащие соединения, изучаются в неорганической химии.
Молекулы также играют важную роль в биологии. Биологические молекулы, такие как ДНК, белки и липиды, участвуют в различных биологических процессах и являются основой жизненных форм.
Изучение молекул позволяет химикам понять и контролировать различные химические процессы, разрабатывать новые материалы и лекарства, а также создавать новые технологии. Правильное использование и понимание молекул играет важную роль в развитии науки и промышленности.
Основные принципы формирования двухатомных молекул

Первым принципом формирования двухатомных молекул является ионизация атомов. Атомы веществ могут образовывать ионы, приобретая положительный или отрицательный заряд. Ионы различных элементов имеют разную электроотрицательность, что позволяет им образовывать различные соединения и молекулы.
Вторым принципом является образование ковалентных связей. Ковалентная связь - это сила притяжения между атомами, основанная на обмене электронами. Для образования ковалентной связи атомы должны иметь свободные электроны в своей внешней оболочке, чтобы они могли быть общими для двух атомов.
Третьим принципом формирования двухатомных молекул является молекулярная орбиталь. Молекулярная орбиталь - это зона пространства, в которой находятся электроны в молекуле. Она формируется путем наложения атомных орбиталей двух атомов, в результате чего происходит образование новых орбиталей.
Основные принципы формирования двухатомных молекул позволяют понять структуру и свойства многих химических соединений. Их изучение имеет большое значение для развития химии и применения в различных отраслях науки и технологии.
Электронная структура молекул
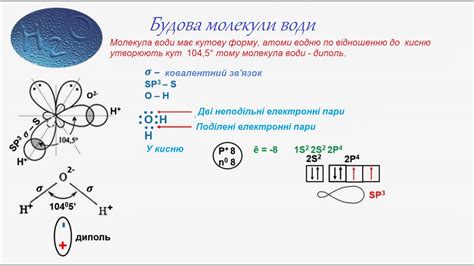
Электронная структура молекул определяет их химические и физические свойства. Молекулы состоят из атомов, которые в свою очередь состоят из электронов, протонов и нейтронов. Электроны находятся вокруг ядра атома и занимают энергетические уровни.
В двухатомных молекулах каждый атом вносит свой вклад в общую электронную структуру. Основная задача при изучении электронной структуры молекул - определить, как электроны распределены между атомами.
| Молекула | Электронная структура |
|---|---|
| Кислород и азот | Одиночная связь: O=O или N≡N |
| Метан | Четыре одиночные связи: C-H |
| Аммиак | Три одиночные связи и одна несвязанная пара электронов: N-H |
Электронная структура молекул может быть определена с использованием различных теорий, таких как теория Вальенса и теория молекулярных орбиталей. Эти теории позволяют описать энергетические уровни электронов и взаимодействие между атомами в молекуле.
Зная электронную структуру молекул, можно делать прогнозы относительно их стабильности и реакционной способности. Электронная структура также играет важную роль в понимании молекулярной геометрии и связи между атомами.
Примеры двухатомных молекул:
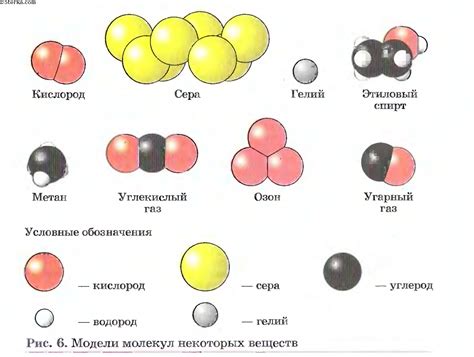
Диоксид углерода (CO2) - это другой пример двухатомной молекулы. Он состоит из двух атомов кислорода (O) и одного атома углерода (C). Диоксид углерода является одним из основных газов в атмосфере и является продуктом сгорания топлива. Он также широко используется в продуктах питания и напитках в качестве добавки для создания газировки.
Сульфид водорода (H2S) - это двухатомная молекула, состоящая из двух атомов водорода (H) и одного атома серы (S). Сульфид водорода является газом с характерным запахом гниения яиц и широко используется в промышленности, включая производство серной кислоты и в качестве сырья для синтеза других химических соединений.
Окись азота (NO) - это двухатомная молекула, состоящая из одного атома азота (N) и одного атома кислорода (O). Она является одним из основных составных газов атмосферы и участвует в процессе образования кислотных осадков и азотистых оксидов в атмосфере. Окись азота также широко используется в медицине в качестве препарата для облегчения ангины.
Метан (CH4) - это газообразное соединение, состоящее из одного атома углерода (C) и четырех атомов водорода (H). Метан является одним из основных компонентов природного газа и широко используется в промышленности и бытовых целях. Он также является одним из основных газов, вызывающих парниковый эффект и изменение климата.
Вода (H2O) - это двухатомная молекула, состоящая из двух атомов водорода (H) и одного атома кислорода (O). Вода является одним из самых важных веществ на Земле и играет роль во многих биологических процессах. Он также используется в промышленности для охлаждения и в бытовых целях для питья и приготовления пищи.
Молекулы водорода и кислорода

Молекула водорода (H2) состоит из двух атомов водорода, связанных с помощью ковалентной связи. Водород - самый легкий элемент в периодической таблице, и его молекулы обладают высокой подвижностью. Водород широко используется в промышленности в качестве сырья для производства различных веществ, включая аммиак, воду и многие другие.
Молекула кислорода (O2) также состоит из двух атомов, но отличается от молекулы водорода своими физическими свойствами. Оксиген является существенным для поддержания жизни на Земле и необходим для дыхания живых организмов. Кроме того, кислород играет важную роль в окислительно-восстановительных реакциях и в процессе сжигания топлива.
Вместе молекулы водорода и кислорода образуют воду (H2O) - основное вещество, встречающееся на поверхности Земли. Вода играет ключевую роль во многих биологических и химических процессах, и без нее не могла бы существовать жизнь на Земле.
Молекулы водорода и кислорода имеют большое значение для понимания химических реакций, энергетических процессов и многих других аспектов нашего мира. Они являются основой для многих других молекул и соединений, и их изучение помогает расширить наше знание о составе и структуре вещества.
Реакции и свойства двухатомных молекул
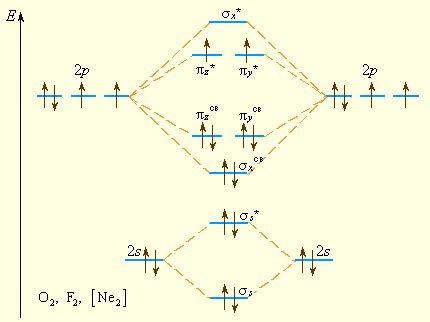
Одной из основных характеристик двухатомных молекул является их длина связи. Длина связи между двумя атомами в молекуле зависит от типа связи и электронной структуры. Более короткая связь обычно указывает на более сильную связь между атомами и более стабильную молекулу.
Двухатомные молекулы также проявляют разнообразные химические реакции. Некоторые из них включают образование и разрыв связей, преобразование структуры молекулы и образование новых соединений.
Одной из типичных реакций двухатомных молекул является реакция диссоциации. Во время этой реакции связь между атомами разрывается, образуя два или больше отдельных атомов или ионов.
Еще одной важной реакцией двухатомных молекул является реакция ассоциации. Во время этой реакции два или более атома или иона объединяются, образуя новую связь и создавая более сложную молекулу.
Свойства двухатомных молекул также связаны с их энергетическими уровнями и электронной структурой. Они могут обладать электронными переходами, альтернативными конфигурациями и спектральными свойствами, которые могут быть использованы для определения их присутствия и характеристик в природе.
| Свойство | Описание |
|---|---|
| Полярность | Двухатомные молекулы могут быть полярными или неполярными в зависимости от разности электроотрицательностей атомов и геометрии молекулы. |
| Точка кипения и плавления | Свойства двухатомных молекул также могут быть связаны с физическими характеристиками, такими как точка кипения и плавления, которые зависят от сил межмолекулярных взаимодействий. |
| Химическая активность | Двухатомные молекулы могут проявлять химическую активность, способность реагировать с другими соединениями, подвергаться окислению или восстановлению, образовывать структуры с различными свойствами. |
Понимание реакций и свойств двухатомных молекул является важным шагом в понимании химических процессов и разработке новых веществ с определенными свойствами и функциями.
Взаимодействия с другими элементами
Двухатомные молекулы могут взаимодействовать с другими элементами и соединениями, образуя различные химические реакции.
Одним из примеров является взаимодействие двухатомных молекул с кислородом. В результате этого взаимодействия может происходить окисление молекулы, что приводит к образованию нового соединения. Например, взаимодействие двухатомного кислорода с молекулой водорода приводит к образованию воды.
Другим примером взаимодействия двухатомных молекул является их растворение в других веществах. Например, молекулы двухатомного кислорода могут растворяться в воде, образуя растворимое вещество. Это взаимодействие играет важную роль в многих биологических процессах, таких как дыхание организмов.
Взаимодействия двухатомных молекул с другими элементами и соединениями влияют на их свойства и химические реакции. Изучение этих взаимодействий позволяет разрабатывать новые материалы и применять двухатомные молекулы в различных областях науки и технологии.
Значение двухатомных молекул в природе

Одним из примеров двухатомных молекул, которые имеют большое значение в природе, является молекула кислорода (O2). Кислород является важнейшим элементом для жизни на Земле. Он играет ключевую роль в дыхании живых организмов, а также в процессе окисления органических соединений в химических реакциях.
Еще одним примером двухатомной молекулы, обладающей большим значением в природе, является молекула азота (N2). Азот является составной частью многих биологических соединений, включая аминокислоты, составляющие белки, и нуклеотиды, составляющие ДНК и РНК. Азот также играет важную роль в процессе азотфиксации, в результате которого азот в атмосфере превращается в биологически доступные формы для растений.
Кроме того, двухатомные молекулы, такие как диоксид углерода (CO2), окись азота (NO), аммиак (NH3) и другие, играют важную роль в геохимических процессах, климатических изменениях и экологических системах.
Таким образом, значение двухатомных молекул в природе широко распространено и неоценимо, и их изучение позволяет получить глубокие знания о фундаментальных процессах, происходящих в различных сферах природы.



