Водород и фтор - два элемента, которые имеют некоторые общие характеристики в своем строении. Оба они относятся к группе галогенов в периодической таблице химических элементов и имеют схожую структуру электронных оболочек.
Электронная конфигурация водорода и фтора описывает расположение электронов в их атомах и определяет их химические свойства. Оба элемента имеют один электрон в валентной оболочке, что делает их очень реактивными и способными образовывать химические связи с другими элементами.
Одним из главных общих свойств водорода и фтора является их способность образовывать стабильные молекулы. Водород обычно образует молекулы H2, состоящие из двух атомов водорода, в то время как фтор образует молекулы F2, состоящие из двух атомов фтора. Оба этих вещества являются газами при стандартных условиях.
Строение водорода и фтора: основные схожести
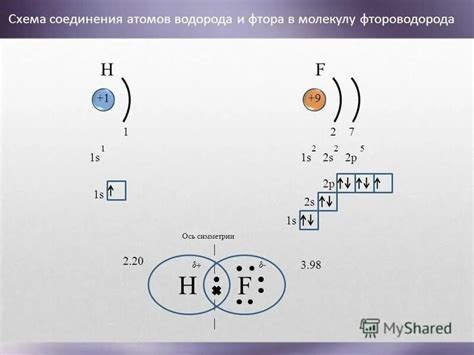
Основное сходство между водородом и фтором заключается в составе и строении их атомов. Оба элемента состоят из одного электрона во внешней оболочке и обладают одним электроном в атомном водороде. Тем не менее, в фторе на внешней оболочке находятся семь электронов.
Также водород и фтор являются газами при нормальных условиях и обладают хорошей растворимостью в воде. Они оба образуют соединения с множеством элементов и являются активными химическими агентами.
И, наконец, водород и фтор обладают высокой электроотрицательностью и образуют сильные химические связи с другими элементами. Фтор, будучи самым электроотрицательным элементом в периодической системе, является самым сильным окислителем из всех химических элементов.
Элементарное строение атомов
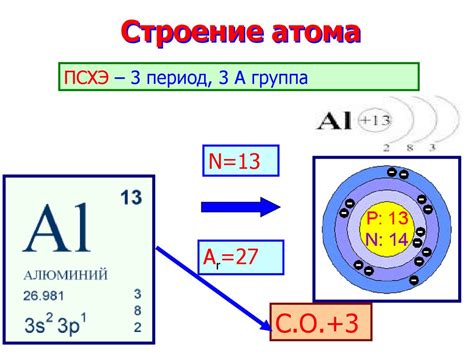
Протоны и нейтроны находятся в ядре атома, которое обладает положительным зарядом. Электроны располагаются вокруг ядра на энергетических уровнях и имеют отрицательный заряд.
Водород и фтор являются примерами атомов, состоящими из разных чисел протонов, нейтронов и электронов. Атом водорода содержит один протон, один электрон и ноль нейтронов. Атом фтора содержит девять протонов, девять электронов и девять (или около девяти) нейтронов.
Водород и фтор также имеют различные химические свойства. Водород хорошо смешивается с другими элементами и может выступать в реакциях с различными веществами. Фтор, напротив, обладает высокой химической активностью и способен реагировать с большим количеством других элементов.
| Элемент | Протоны | Нейтроны | Электроны |
|---|---|---|---|
| Водород | 1 | 0 | 1 |
| Фтор | 9 | 9 (или около девяти) | 9 |
Общие свойства электронной оболочки
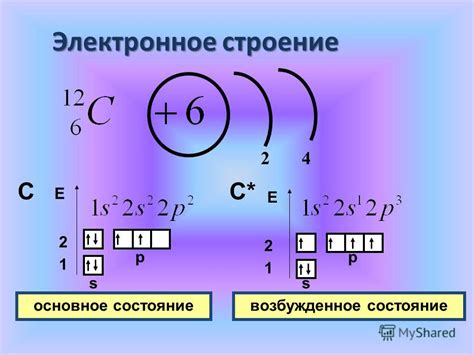
Электронная оболочка атома водорода и фтора имеет ряд общих свойств:
- Обе электронные оболочки состоят из энергетических уровней, на которых располагаются электроны. Водород имеет один электрон в своей оболочке, а фтор имеет семь электронов.
- Наиболее близкие по энергии уровни в оболочках водорода и фтора называются соответственно квантовыми оболочками и подуровнями. Они характеризуются определенной энергией и способностью взаимодействовать с другими атомами и ионами.
- Обе электронные оболочки могут быть представлены в виде сферической симметрии, внутри которой располагаются электроны на разных энергетических уровнях. Также в оболочках могут находиться подуровни различных форм, таких как s, p, d, f.
- Электроны в оболочках обладают электрическим зарядом и движутся по определенным орбитам вокруг ядра. Распределение электронов на энергетических уровнях определяет свойства атома и его возможности по химическому взаимодействию с другими атомами.
Влияние строения на химические свойства

Строение молекулы играет важную роль в определении химических свойств вещества. В случае водорода и фтора, их строения имеют ряд схожих особенностей, которые оказывают влияние на взаимодействия с другими веществами.
В обоих случаях, водород и фтор образуют диатомные молекулы, состоящие из двух атомов. У них одинаковая степень окисления, равная нулю. Оба элемента обладают высокой электроотрицательностью, но у фтора она выше, чем у водорода.
Однако, несмотря на схожие химические свойства, молекулы водорода и фтора имеют различные связи. Водаород образует одну сигма-связь посредством обмена электронами с другим атомом водорода, что характерно для молекул с одинарной связью. Фтор же образует одну сигма-связь и три пи-связи, обеспечивая более сложную структуру молекулы.
Такое различие в строении связей водорода и фтора влияет на их свойства. Например, наличие пи-связей в молекуле фтора делает ее более нестабильной и активной химическим веществом, способным к реакциям с другими элементами. Водород же, благодаря простому строению связи, проявляет менее выраженную химическую активность.
Строение водорода и фтора также оказывает влияние на физические свойства данных элементов. Например, валентность фтора гораздо выше, чем валентность водорода, что объясняет его способность образовывать множество соединений с другими элементами.
Таким образом, строение молекулы имеет существенное значение для понимания и описания химических свойств водорода и фтора. Оно определяет их химическую активность и способность к взаимодействию с другими элементами, а также их физические свойства.
Водород и фтор: роль в природных процессах
Водород является самым легким элементом в периодической таблице, он обладает высокой реактивностью и широко распространен во всей природе. Водород образует связи с другими элементами, образуя различные соединения. Он является важным компонентом органических веществ и встречается во многих природных материалах, таких как вода, углеводороды и биомасса.
Фтор также является очень реактивным элементом и является самым электроотрицательным из всех элементов. Он образует сильные химические связи с другими элементами, что делает его полезным во многих отраслях промышленности. Фтор и его соединения используются в производстве различных продуктов, включая пластмассы, лекарства и химические реагенты.
| Свойство | Водород | Фтор |
|---|---|---|
| Атомный номер: | 1 | 9 |
| Массовое число: | 1 | 19 |
| Плотность: | 0.0899 г/л | 1.696 г/л |
| Точка кипения: | -252.9 °C | -188.1 °C |
| Точка плавления: | -259.2 °C | -219.6 °C |
Как видно из таблицы, водород и фтор имеют различные физические свойства, которые определяют их роль в природных процессах. Водород, например, является основным компонентом воды, которая играет важную роль в гидрологическом цикле. Он также является ключевым компонентом водородных соединений, влияющих на добычу углеводородов из различных источников и производство энергии.
Фтор, в свою очередь, встречается во многих минералах и природных водах. Он играет важную роль в геологических процессах, таких как образование флюоритовых руд и магматических пород. Фтор также имеет важное значение для живых организмов, поскольку он входит в состав зубов и костей и участвует в обмене веществ.
Таким образом, водород и фтор играют важную роль в различных природных процессах, обусловленную их физическими и химическими свойствами. Их присутствие в природе оказывает значительное влияние на окружающую среду и имеет значение для поддержания жизни на Земле.
Применение водорода и фтора в промышленности и научных исследованиях

Водород широко используется в промышленности для производства аммиака, метанола, водородной пероксида и других химических соединений. Он также является важным компонентом в процессе получения поверхностей электрохимической обработки и водородных топливных элементов. В научных исследованиях водород применяется для изучения его способностей в качестве чистого топлива, а также для исследования физических и химических свойств различных материалов.
Фтор, сильнейший из известных химических реагентов, широко используется в промышленности для производства хлора, алюминия, фторированных углеводородов и других продуктов. Фтор также применяется в процессе получения стекла, керамики и самоочищающихся поверхностей. В научных исследованиях фтор используется для изучения его влияния на различные процессы, такие как каталитические реакции и химические обмены.



