Термохимическое уравнение реакции – это обозначение изменения энергии, сопровождающего химическую реакцию. Понимание термохимических уравнений играет ключевую роль в изучении энергетики реакций и прогнозировании их характеристик. Основополагающим принципом при составлении термохимических уравнений является закон сохранения энергии.
Каждое термохимическое уравнение состоит из трех основных компонентов: реагентов, продуктов и изменения энергии. Реагенты представляют собой вещества, проходящие химическую реакцию, а продукты - вещества, образованные в результате реакции. Изменение энергии обозначает разницу между энергией реагентов и энергией продуктов до и после реакции соответственно.
Составление термохимического уравнения реакции может быть сложной задачей, требующей хорошего знания химических принципов и умения применять их. Однако, есть несколько простых правил, которые помогут вам правильно составить уравнение.
Определение термохимического уравнения

Термохимическое уравнение обычно записывается в виде химического уравнения, расширенного с указанием теплового эффекта реакции. Такое уравнение содержит информацию о тепловом энергетическом эффекте – тепле, поглощаемом или высвобождаемом в процессе реакции.
Термохимическое уравнение может быть использовано для вычисления количества высвобождаемой или поглощаемой энергии, а также для определения изменения энтальпии реакции (ΔH). ΔH является важной характеристикой химической реакции, позволяющей оценить ее энергетическую эффективность.
Определение термохимического уравнения включает в себя два основных этапа:
- Составление химического уравнения, указывающего на состав реагентов и продуктов реакции;
- Подставление значений энергетических параметров (теплового эффекта или энтальпии) в уравнение с учетом стоимости реагентов и продуктов.
| Пример | Химическая реакция | Тепловой эффект (ΔH) |
|---|---|---|
| 1 | 2H2(g) + O2(g) → 2H2O(l) | -286 kJ/mol |
| 2 | CH4(g) + 2O2(g) → CO2(g) + 2H2O(g) | -890 kJ/mol |
| 3 | 2C(s) + H2(g) → C2H2(g) | 226 kJ/mol |
В приведенной таблице приведены примеры термохимических уравнений с указанием теплового эффекта реакции. Знание энергетических данных позволяет оценить изменение энтальпии и тепловую эффективность данных реакций.
Краткое описание и принципы составления

Принципы составления термохимического уравнения:
- Уравняйте химическое уравнение для реакции, указав правильные коэффициенты перед частицами вещества.
- Определите все вещества, участвующие в реакции, и запишите их формулы.
- Укажите состояние вещества (газ, жидкость, твердое вещество) с помощью соответствующих обозначений в нижнем индексе реактивов и продуктов.
- Определите изменение энтальпии (теплового эффекта) реакции, указав его в форме термохимического уравнения.
- Обозначьте физические условия при которых проводится реакция (температура, давление и другие).
Пример составления термохимического уравнения:
| Реакция | Термохимическое уравнение |
|---|---|
| Сгорание метана (CH4) в кислороде (O2) | CH4 + 2O2 → CO2 + 2H2O |
| Известняк (CaCO3) распадается на известь (CaO) и углекислый газ (CO2) | CaCO3 → CaO + CO2 |
Роль термохимических уравнений в химии

Термохимические уравнения играют важную роль в химии, позволяя описывать и предсказывать химические реакции на основе энергетических изменений, происходящих в процессе.
Термохимическое уравнение содержит информацию о тепловых эффектах реакции, таких как изменение энтальпии (ΔH), которая характеризует количество энергии, поглощаемой или выделяющейся в процессе реакции. При помощи термохимических уравнений можно определить, является ли реакция эндотермической (поглощает тепло) или экзотермической (выделяет тепло), а также расчетно определить количество поглощаемого или выделяющегося тепла.
Термохимические уравнения также позволяют сравнивать энергетические характеристики различных химических реакций. Например, сравнение энтальпий образования разных веществ позволяет определить, какая из реакций будет более выгодной с энергетической точки зрения.
Кроме того, термохимические уравнения имеют и практическое применение. Они могут использоваться для расчета энергетических параметров, в том числе энергии активации реакции, что может быть полезно при проектировании химических реакторов или определении термической стабильности соединений.
Таким образом, термохимические уравнения являются важным инструментом в химии, не только для описания и предсказания химических реакций, но и для понимания и изучения энергетических аспектов химических процессов.
Примеры применения в различных химических процессах
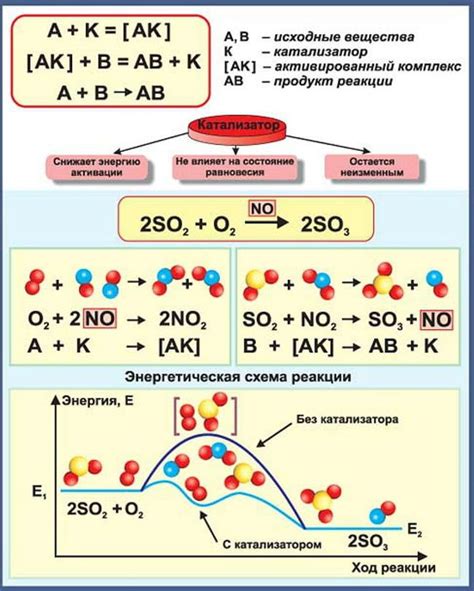
Сжигание топлива. Термохимические уравнения используются для расчета теплоты, которая выделяется при сжигании различных видов топлива. Например, при сжигании горючих газов или угля термохимические уравнения позволяют определить выделяющуюся теплоту и эффективность процесса.
Синтез химических веществ. Термохимические уравнения могут применяться для определения энергии, которая требуется для проведения синтеза химических веществ. Например, при производстве аммиака из азота и водорода термохимические уравнения показывают энергию, необходимую для проведения этого процесса и определения его экономической и экологической целесообразности.
Процессы электролиза. Термохимические уравнения позволяют определить энергию, необходимую для проведения электролиза различных веществ. Например, при электролизе воды термохимические уравнения показывают, сколько энергии нужно подать для разложения воды на кислород и водород.
Реакции горения. Термохимические уравнения позволяют определить изменение энергии, которое происходит при горении различных веществ. Например, при сжигании древесины термохимические уравнения показывают, сколько энергии выделяется при горении и какую тепловую мощность можно получить из данного источника.
Это лишь небольшая часть примеров применения термохимических уравнений в различных химических процессах. Знание термохимии позволяет более глубоко понять и контролировать химические превращения и энергетические параметры различных реакций.
Шаги составления термохимического уравнения
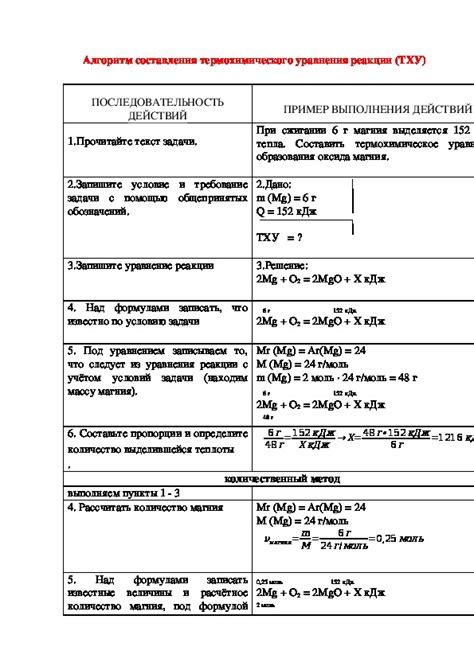
Составление термохимического уравнения основано на следующих шагах:
- Изучение и исследование реакции. Измерение тепловых эффектов, таких как теплота образования, теплота растворения или теплота сгорания, связанных с данной реакцией.
- Определение общего химического уравнения для реакции. Включение всех реагентов и продуктов, а также указание их коэффициентов.
- Нахождение уравнения для каждой тепловой реакции, которая связана с данной химической реакцией. Такие уравнения обычно основаны на измеренных тепловых эффектах и могут включать связанные с реакцией вещества с известными энтальпиями образования или сгорания.
- Уравновешивание уравнений. Все уравнения, включая общее химическое уравнение и тепловые уравнения, должны быть уравновешены по числу атомов каждого элемента и по энергии.
- Составление окончательного термохимического уравнения. Это уравнение будет содержать общее химическое уравнение и все тепловые уравнения, связанные с данной реакцией.
После выполнения всех этих шагов, термохимическое уравнение будет полностью сформировано и сможет предоставить информацию о тепловых эффектах, связанных с химической реакцией. Это позволяет исследовать и предсказывать термодинамические свойства системы и использовать их для различных практических и научных целей.
Анализ исходных реакций
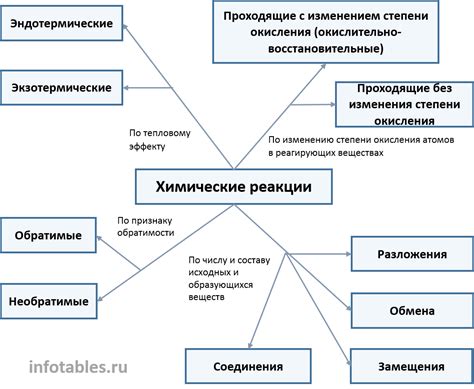
Перед составлением термохимического уравнения реакции необходимо провести анализ исходных реакций, чтобы понять, какие вещества участвуют в реакции и какие изменения происходят с энергетическими параметрами.
Для начала, нужно определить, какие реактивы и продукты присутствуют в уравнении реакции. Реактивы - это вещества, которые участвуют в начальной стадии реакции, а продукты - это вещества, образующиеся в результате реакции.
Затем следует определить состояние веществ до и после реакции. Вещества могут быть в разных агрегатных состояниях: газообразном, жидком или твердом. Изменения состояния веществ можно учесть в термохимическом уравнении реакции.
Также необходимо учесть количество веществ, участвующих в реакции. Коэффициенты перед формулами веществ показывают их относительные молевые количества.
| Реактивы | Продукты | Коэффициенты |
|---|---|---|
| Вещество 1 | Вещество 2 | 1 |
| Вещество 3 | Вещество 4 | 2 |
| Вещество 5 | Вещество 6 | 3 |
В таблице выше приведены примеры исходных реакций с указанием реактивов, продуктов и их коэффициентов.
Анализ исходных реакций является важным шагом в составлении термохимического уравнения реакции. Он позволяет определить все необходимые компоненты и параметры, которые необходимо учесть при составлении уравнения.



