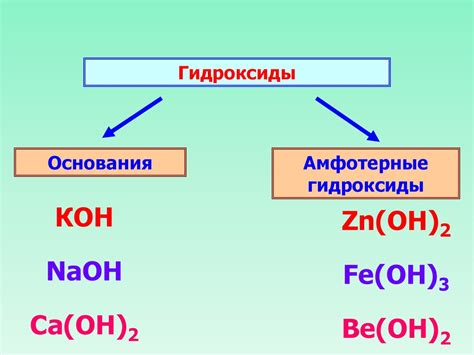
Высшие гидроксиды - это класс химических соединений, которые образуются при реакции основания с водой. Они состоят из иона гидроксида (OH-) и металла. Такие соединения имеют широкое применение в различных областях, включая промышленность, медицину и научные исследования.
Состав высшего гидроксида зависит от металла, который входит в его состав. Металл может быть алкалием, щелочной землей или переходным. Наиболее распространенным примером высшего гидроксида является гидроксид натрия (NaOH), который состоит из ионов натрия (Na+) и гидроксида (OH-). Другие примеры включают гидроксид калия (KOH), гидроксид кальция (Ca(OH)2) и гидроксид алюминия (Al(OH)3).
Характер высшего гидроксида определяется его свойствами и возможными реакциями. Оно проявляет как кислотные, так и основные свойства, в зависимости от условий среды. Водные растворы высших гидроксидов обладают щелочными свойствами и являются отличными основаниями. Они хорошо растворимы в воде и могут образовывать сильные растворы. Высшие гидроксиды также могут реагировать с кислотами, образуя соль и воду.
Состав высшего гидроксида: основные компоненты

Высший гидроксид представляет собой сложное химическое соединение, содержащее основные компоненты, которые определяют его свойства и характеристики.
Основными компонентами высшего гидроксида являются:
- Металлы
- Группы гидроксильных ионов
- Анионы, образующие гидроксид
Металлы, такие как натрий, калий, алюминий, железо и другие, представляют собой основную составляющую высшего гидроксида. Они обладают высокой реакционной способностью и образуют стабильные соединения с гидроксильными группами.
Гидроксильные группы - OH- являются основными составляющими молекулы гидроксида. Они обладают отрицательным зарядом и крепко связаны с металлами, образуя структуру высшего гидроксида.
Анионы, такие как карбонат, сульфат, фосфат и другие, являются важными компонентами высшего гидроксида. Они влияют на его структуру, растворимость и реакционную способность.
Состав высшего гидроксида определяет его свойства и способность к образованию соединений. Например, гидроксид натрия NaOH, гидроксид калия KOH и другие высшие гидроксиды обладают различными физическими и химическими свойствами в зависимости от их состава и структуры.
Гидроксид металла: сущность и свойства
Гидроксиды металла обладают рядом характерных свойств. Во-первых, они слабо растворимы в воде и образуют осадок при реакции с кислотами. Во-вторых, они обладают щелочными свойствами и способны образовывать растворы с щелочной реакцией. Это значит, что они обладают способностью отщелачивать кислоты.
Гидроксиды металла широко используются в промышленности и быту. Например, гидроксид натрия (NaOH), или каустическая сода, применяется при производстве мыла, стекла, бумаги и других продуктов, а также в различных химических процессах и сточных водах.
Важно отметить, что гидроксиды металла могут быть ядовитыми и вызывать раздражение при контакте с кожей или слизистыми оболочками. Поэтому при работе с этими веществами необходимо соблюдать меры предосторожности и использовать защитные средства.
Гидроксид кислоты: структура и реакция
Гидроксид кислоты представляет собой соединение, образующееся в результате реакции между гидроксидом металла и кислотой. Оно имеет уникальную структуру и обладает рядом характеристических свойств.
Структура гидроксида кислоты состоит из иона металла, которому приписана положительная зарядка, и иона гидроксила, содержащего группу OH-. Оба иона могут образовывать кристаллическую решетку, которая определяет физические свойства соединения. Именно благодаря своей структуре гидроксид кислоты может образовать гранулы, кристаллы или пластинки в зависимости от условий образования.
Реакция гидроксида кислоты характеризуется образованием воды и соли. В процессе нейтрализации кислота отдает протон (H+) и соединяется с ионом гидроксила. Результатом реакции является образование воды (H2O), а ион металла соединяется со снятым протоном, образуя соль. Каждая гидроксидная реакция имеет свои особенности в зависимости от кислоты и металла, участвующих в процессе.
Гидроксид кислоты широко используется в различных отраслях, в том числе в химической промышленности, фармацевтике и сельском хозяйстве. Этот соединение обладает свойствами, такими как щелочность, водоудерживающая способность и антибактериальная активность, что делает его незаменимым компонентов многих продуктов и процессов.
Характеристики высшего гидроксида

- Щелочность: Высший гидроксид обладает высокой щелочностью, что делает его одним из наиболее сильных щелочей. Он может растворяться в воде, образуя щелочные растворы с высоким уровнем pH.
- Реактивность: Гидроксиды часто проявляют высокую реактивность и могут взаимодействовать с различными веществами, такими как кислоты, соли и токсичные вещества. Это делает высший гидроксид полезным как реагент в химических процессах и промышленности.
- Физические свойства: Высший гидроксид обычно является твердым веществом, хотя некоторые могут быть и в жидком состоянии при комнатной температуре. Он может обладать различными цветами, в зависимости от металла, из которого он образован.
В высшем гидроксиде есть и другие особенности, такие как его способность образовывать соли с кислотами и растворяться в них, а также его использование в различных промышленных процессах, включая производство бумаги и очистку воды. Он также может быть используется в медицине, косметике и других отраслях.
Физические свойства: состояние и температура
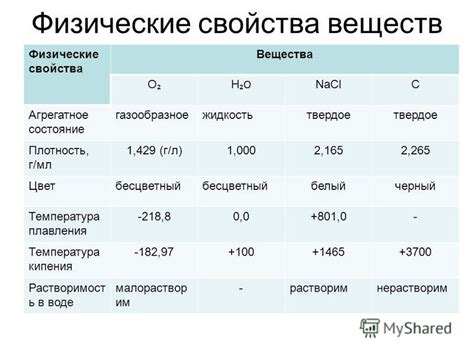
Высшие гидроксиды обладают различным состоянием при разных температурах. В обычных условиях они представляют собой твёрдые кристаллы или порошок. Однако, некоторые высшие гидроксиды могут быть источниками падения капель, что обозначает их наличие в жидком состоянии при комнатной температуре. Примером такого соединения может служить гидроксид калия (KOH).
Температура является фактором, который значительно влияет на состояние и свойства высшего гидроксида. При повышении температуры, обычно, происходит увеличение подвижности молекул и атомов, что приводит к возникновению более динамичного состояния соединения. Таким образом, высший гидроксид может переходить из твёрдого состояния в жидкое, а при дальнейшем нагревании даже в газообразное состояние.
Точка плавления позволяет определить температуру, при которой твёрдый гидроксид превращается в жидкость. Например, точка плавления гидроксида натрия (NaOH), одного из наиболее распространенных высших гидроксидов, составляет 318 °C. Это означает, что до этой температуры гидроксид будет находиться в твёрдом состоянии, а после – станет жидкостью.
Полезно знать, что некоторые гидроксиды способны абсорбировать влагу из воздуха, образуя гидраты. Такие гидратированные формы гидроксида имеют отличный набор свойств и часто используются в различных областях.
Химические свойства: реакции и стабильность
Еще одной важной реакцией, свойственной высшим гидроксидам, является взаимодействие с щелочами. В результате такой реакции образуются соответствующие соли и вода. Например, гидроксид калия (KOH) реагирует с гидроксидом натрия (NaOH) и образует карбонат калия (K2CO3) и воду (H2O).
Стабильность высших гидроксидов зависит от их химической структуры и условий окружающей среды. Некоторые высшие гидроксиды могут быть стабильными при обычных условиях, однако при повышенных температурах или воздействии кислоты они могут разлагаться. Например, гидроксид алюминия (Al(OH)3) при нагревании разлагается на оксид алюминия (Al2O3) и воду (H2O).
Биологическая активность гидроксида

В биологии гидроксиды играют важную роль. Например, гидроксид кальция (Ca(OH)2), также известный как известь, применяется для регулирования кислотности почвы в сельском хозяйстве. Кроме того, он используется в производстве строительных материалов, в медицине в качестве антацидного средства и в стоматологии для лечения зубной эрозии и отбеливания зубов. Гидроксид железа (Fe(OH)3) применяется в лечении анемии, когда необходимо повысить содержание железа в организме.
Однако гидроксиды также могут быть ядовитыми и вызывать различные побочные эффекты. Например, гидроксид натрия (NaOH) является сильным щелочным веществом и может вызывать ожоги кожи и слизистых оболочек.
Биологическая активность гидроксидов может варьироваться в зависимости от их состава и концентрации. Некоторые гидроксиды могут проявлять антимикробную активность и использоваться в медицине для борьбы с инфекциями. Например, гидроксид цинка (Zn(OH)2) используется в составе антисептических и дезинфицирующих средств.
При использовании гидроксидов необходимо соблюдать осторожность и следовать инструкциям по их применению, чтобы избежать негативных последствий для здоровья.



