Соляная кислота (хлористоводородная кислота) - одна из наиболее важных и широко используемых химических соединений. Её химическая формула HCl является одним из самых простых известных соединений, но при этом она обладает высокой реактивностью и способна вступать во множество химических реакций.
Взаимодействие соляной кислоты с другими веществами имеет множество интересных аспектов. Например, она реагирует с металлами, образуя соли и выделяясь в виде водорода. Такая реакция является классическим примером образования соли при взаимодействии кислоты и основания. Кроме того, соляная кислота способна вступать в реакции окисления, при которых выделяется хлор и образуется кислород.
Важно отметить, что соляная кислота также сильно взаимодействует с органическими веществами, такими как спирты и углеводороды. При этом происходит образование эфиров и хлорированных соединений. Это свойство соляной кислоты широко используется в органической химии для синтеза различных органических соединений.
Соляная кислота и её реакции с веществами

Взаимодействие соляной кислоты с металлами является одной из наиболее известных её реакций. При взаимодействии сильных кислот с металлами образуются соли и выделяется водород. Например, соляная кислота реагирует с цинком, образуя хлорид цинка и выделяя водородный газ:
Zn + 2HCl → ZnCl2 + H2
Также соляная кислота может реагировать с основаниями, образуя соли и воду. Например, реакция соляной кислоты с гидроксидом натрия представлена следующим уравнением:
HCl + NaOH → NaCl + H2O
Кроме того, соляная кислота реагирует с многими органическими соединениями, такими как спирты, амины и карбонильные соединения. В результате таких реакций образуются новые соединения, такие как эфиры, амиды и альдегиды.
Важно помнить, что соляная кислота является сильным коррозивным веществом и обладает ядовитыми свойствами. При работе с ней необходимо соблюдать меры предосторожности, такие как ношение защитной одежды, глаз и рук.
Строение и свойства соляной кислоты

Строение соляной кислоты основано на химической формуле HCl, где один атом водорода связывается с атомом хлора. В молекуле соляной кислоты атом водорода является положительно заряженным, а атом хлора - отрицательно заряженным, что делает кислоту полярной. Это обуславливает ее способность растворять множество других веществ.
Соляная кислота обладает несколькими важными свойствами:
- Кислотность: Соляная кислота является сильной кислотой и образует ионы водорода (H+) в растворе.
- Коррозионность: Из-за своей кислотности соляная кислота обладает высокой коррозионной активностью и может разрушать некоторые металлы и другие материалы.
- Растворимость: Соляная кислота хорошо растворяется в воде и образует одноименный раствор с высокой концентрацией и антибактериальными свойствами.
- Употребление: Соляная кислота широко используется в различных отраслях промышленности, таких как производство удобрений, промышленной химии и фармацевтике.
Изучение структуры и свойств соляной кислоты помогает понять ее поведение и взаимодействия с другими веществами, что имеет большое практическое значение для различных областей науки и технологий.
Взаимодействие соляной кислоты с щелочами

Щелочи, такие как гидроксид натрия (NaOH) или гидроксид калия (KOH), являются основаниями и обладают высоким уровнем щелочности. При реакции соляной кислоты с щелочью происходит нейтрализация, в результате которой образуется соль и вода.
Реакция между соляной кислотой и щелочью можно представить следующим уравнением:
HCl + NaOH → NaCl + H2O
Таким образом, молекула соляной кислоты среагировала с молекулой гидроксида натрия, образуя молекулы соли (хлорида натрия) и воды. Такая реакция является экзотермической, то есть сопровождается выделением тепла.
При взаимодействии другой щелочи, например, гидроксида калия, реакция будет протекать аналогичным образом:
HCl + KOH → KCl + H2O
Такие реакции сопровождаются выделением тепла и называются нейтрализационными реакциями. Они используются как основа для получения различных солей и очистки отходов, содержащих кислоты или щелочи.
Важно отметить, что при взаимодействии соляной кислоты с щелочами необходимо соблюдать меры предосторожности, так как такие реакции могут происходить с выделением тепла и разбрызгиванием кислоты. Работа с кислотами и щелочами должна проводиться в специальных защитных средствах и под контролем опытного персонала.
Реакции соляной кислоты с металлами

Реакция соляной кислоты с металлами происходит в результате образования солей и выделения водорода. Во время реакции соляной кислоты с металлами происходит окисление металла и одновременное восстановление кислорода кислоты.
Например, реакция соляной кислоты с цинком (Zn) приводит к образованию соли хлорида цинка (ZnCl2) и выделению водорода:
- Zn + 2 HCl → ZnCl2 + H2
Реакция соляной кислоты с алюминием (Al) приводит к образованию соли хлорида алюминия (AlCl3) и выделению водорода:
- 2 Al + 6 HCl → 2 AlCl3 + 3 H2
Реакция соляной кислоты с железом (Fe) приводит к образованию соли хлорида железа (FeCl2 или FeCl3) и выделению водорода:
- 2 Fe + 6 HCl → 2 FeCl2 + 3 H2
- 2 Fe + 6 HCl → 2 FeCl3 + 3 H2
Реакция соляной кислоты с некоторыми металлами, такими как магний (Mg) и алюминий (Al), может проходить с выделением газа в виде пузырьков. В этом случае газом является водород.
Реакции соляной кислоты с металлами широко используются в различных областях, включая промышленность, химическую лабораторию и повседневную жизнь. Эти реакции не только позволяют получать соли, но и применяются в качестве метода очистки и травления поверхностей металлов.
Взаимодействие соляной кислоты с оксидами

Оксиды - это химические соединения, состоящие из атомов кислорода в анионах, соединенных с атомами других элементов. Взаимодействие соляной кислоты с оксидами приводит к образованию солей и воды.
1. Взаимодействие соляной кислоты с оксидами неметаллов:
Когда соляная кислота взаимодействует с оксидами неметаллов, образуется соль этого неметалла и вода. Примерами являются реакция соляной кислоты с оксидом углерода (IV) и оксидом серы (VI):
CO2 + 2HCl → H2CO3 + Cl2O
SO3 + HCl → H2SO4 + Cl2O
2. Взаимодействие соляной кислоты с оксидами металлов:
Когда соляная кислота взаимодействует с оксидами металлов, образуется соль металла и вода. Примером является реакция соляной кислоты с оксидом натрия:
Na2O + 2HCl → 2NaCl + H2O
Эти реакции широко применяются в промышленности для получения соответствующих солей и более сложных соединений.
Таким образом, взаимодействие соляной кислоты с оксидами является важным аспектом химических реакций. Оно позволяет получить соли и воду, которые имеют множество применений в различных отраслях нашей жизни.
Применение соляной кислоты в промышленности и быту
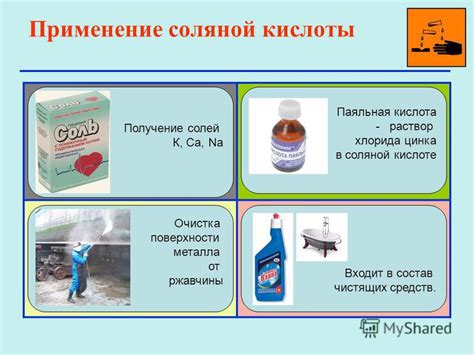
Соляная кислота, или хлороводородная кислота, широко используется в различных отраслях промышленности. Её высокая реакционная способность и агрессивные свойства позволяют применять её в самых разных процессах и целях.
Одним из основных применений соляной кислоты является её использование при производстве химических веществ. Она используется в качестве реагента или катализатора при синтезе различных соединений. Также с её помощью можно осуществлять неорганическую аналитику и множество других процессов.
Соляная кислота также используется при очистке и обработке металлических поверхностей. Она способна растворять окислы и другие загрязнения, делая поверхности металла готовыми к покрытиям и защите. Такой процесс называется пасивацией и широко применяется в автомобильной и аэрокосмической промышленности.
В быту соляная кислота также может найти своё применение. Она может использоваться для удаления накипи, ржавчины и других загрязнений с сантехнических изделий. Также она может быть использована для очистки унитазов и засоров в трубах.
Однако необходимо помнить, что соляная кислота имеет высокую степень опасности: она является ядовитой и её использование требует особой осторожности и соблюдения мер безопасности.



