Энергия электрона в атоме является одной из фундаментальных характеристик атома. Она определяется рядом факторов, которые влияют на положение электрона в атоме и его способность участвовать в химических реакциях.
Первым фактором, определяющим энергию электрона, является его главное квантовое число, обозначаемое как n. Чем выше значение n, тем выше энергия электрона. Это связано с тем, что электроны с более высокими значениями n находятся на более удаленных от ядра орбиталях. Таким образом, энергия электрона растет с увеличением его расстояния от ядра атома.
Один из важных факторов, влияющих на энергию электрона, - это его атомное число, обозначаемое как Z. Значение Z определяет количество протонов в ядре атома, а также количество электронов в атоме в нерелятивистском приближении. Чем больше атомное число, тем больше заряд ядра, и тем выше энергия электрона. Это связано с тем, что с ростом заряда ядра сила притяжения электрона к ядру увеличивается, что приводит к увеличению энергии электрона.
Другим фактором, влияющим на энергию электрона, является его орбитальное квантовое число, обозначаемое как l. Оно определяет форму орбитали электрона и его момент импульса. Различные значения l соответствуют различным формам орбиталей, таким как s, p, d, f. Как правило, энергия электрона находится в энергетически низких уровнях для s-орбиталей, затем для p-орбиталей и так далее. Таким образом, энергия электрона зависит от его орбитальной формы и момента импульса.
Размеры атома и электрона
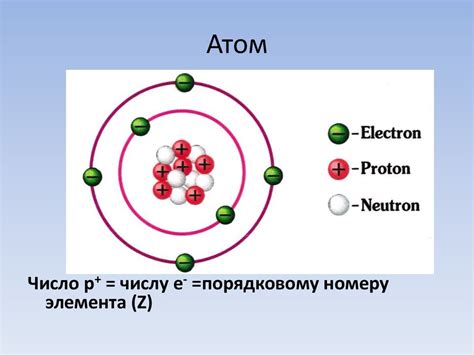
Размер атома определяется диаметром, который примерно равен 10^(-10) метра. Это очень маленький размер, который трудно представить себе. Например, если бы атом был увеличен до размеров футбольного мяча, то его электрон можно было бы представить в размерах макарона.
Электрон, находящийся внутри атома, также обладает своими размерами. Размер электрона количественно определяется его радиусом, который равен примерно 10^(-15) метра. Таким образом, электрон гораздо меньше атома и занимает очень маленькую часть его объема.
Размеры атомов и электронов имеют важное значение при изучении и понимании микромира. Эти размеры помогают объяснить различные явления, связанные с энергией электронов в атомах, взаимодействием атомов и другими свойствами вещества.
Величина ионизационной энергии
Величина ионизационной энергии зависит от ряда факторов. Один из основных факторов - заряд ядра атома. Чем больше заряд ядра, тем сильнее притяжение к нему электронов и, соответственно, выше ионизационная энергия.
Также величина ионизационной энергии зависит от расположения электрона в атоме. Энергия удаления первого электрона (первая ионизационная энергия) обычно ниже, чем энергия удаления последующих электронов. Это связано с тем, что при удалении первого электрона нарушается электронная конфигурация атома, что приводит к увеличению его энергии.
Также величина ионизационной энергии зависит от радиуса атома. Чем больше радиус атома, тем дальше находятся электроны от ядра и тем слабее их связь с ним, что приводит к уменьшению ионизационной энергии.
Ионизационная энергия является важным показателем для определения химических и физических свойств атомов и элементов. Она может использоваться для предсказания реакционной способности атомов и степени их активности в химических процессах.
Валентная электронная оболочка

Количество валентных электронов для каждого элемента определяет их химическую активность. Элементы, имеющие одинаковое количество валентных электронов, обладают схожими химическими свойствами и могут образовывать подобные соединения. Это позволяет классифицировать элементы в соответствии с их электронной конфигурацией и расположением в периодической системе.
Валентные электроны находятся на различных энергетических уровнях внешней оболочки атома. Их энергия зависит от взаимодействия с другими электронами и ядерной силы атома. Моделирование и исследование валентной электронной оболочки позволяют лучше понять свойства и поведение химических элементов в различных условиях и сочетаниях.
Валентная электронная оболочка также определяет энергию электронов в атоме. Энергетические уровни в оболочке разделены на подуровни и орбитали, которые могут заполняться электронами согласно правилам заполнения. Энергия электрона на каждом уровне зависит от электростатического взаимодействия с ядром атома и другими электронами.
Для более сложных атомов с несколькими электронными оболочками валентные электроны обычно находятся на самом высоком энергетическом уровне. Именно они определяют реактивность и способность атома участвовать в химических реакциях и образовывать ковалентные или ионные связи.
Таким образом, валентная электронная оболочка атома является ключевым фактором, определяющим его химические свойства и реактивность. Изучение и понимание этой оболочки позволяет более полно осмыслить строение и взаимодействие атомов, а также использовать полученные знания в химической промышленности и научных исследованиях.
Взаимодействие электрона с ядром

Самое существенное взаимодействие электрона с атомным ядром наблюдается в процессе образования электронных облаков. При этом ядро электроном считается постоянным потенциалом.
В классической механике взаимодействие электрона с ядром описывается законом Кулона о взаимодействии зарядов. Однако, с учетом квантовой механики и пространственного ограничения, модель атома становится более сложной и требует учета дополнительных факторов.
Одним из ключевых факторов взаимодействия электрона с ядром является их зарядовое взаимодействие. Чем больше заряд ядра, тем сильнее будет взаимодействие с электроном.
Другой важный фактор - расстояние между электроном и ядром. Чем ближе электрон к ядру, тем сильнее будет их взаимодействие. Это объясняется тем, что электроны могут находиться в различных энергетических уровнях, и чем ближе уровень к ядру, тем ниже его энергия.
Также влияние на взаимодействие электрона с ядром оказывает его магнитный момент. Это связано с ориентацией магнитного поля, которое создают движущиеся электроны.
Следует отметить, что взаимодействие электрона с ядром не является статическим, а скорее динамическим процессом, который происходит в течение очень коротких промежутков времени.
| Факторы взаимодействия электрона с ядром | Описание |
|---|---|
| Заряд ядра | Чем больше заряд ядра, тем сильнее взаимодействие |
| Расстояние между электроном и ядром | Чем ближе электрон к ядру, тем сильнее взаимодействие |
| Магнитный момент электрона | Ориентация магнитного поля |
Итак, взаимодействие электрона с ядром в атоме зависит от заряда ядра, расстояния между ними и магнитного момента электрона. Эти факторы влияют на энергию электрона и его поведение в атоме.
Энергетический уровень электрона
Энергетический уровень электрона в атоме определяется несколькими важными факторами. Во-первых, влияние ядра атома. Ядро атома создает электростатическое поле, которое взаимодействует с электроном. Чем больше заряд ядра и меньше расстояние до него, тем сильнее это взаимодействие и выше энергия электрона.
Во-вторых, энергетический уровень электрона зависит от его орбитали или квантового состояния. Каждое орбитальное состояние связано с определенной энергией. Чем выше энергия орбитали, тем больше энергия электрона.
Другой важный фактор - электронные конфигурации. Количество и распределение электронов в атоме определяют его энергетические уровни. Каждый энергетический уровень может содержать определенное количество электронов, и эти электроны могут занимать различные орбитали.
Наконец, влияние внешних факторов, таких как приложенное электромагнитное поле или столкновение с другими частицами, может изменять энергетический уровень электрона.
| Фактор | Описание |
|---|---|
| Ядро атома | Создает электростатическое поле, взаимодействующее с электроном |
| Орбитальное состояние | Связано с определенной энергией электрона |
| Электронные конфигурации | Количество и распределение электронов в атоме |
| Внешние факторы | Приложенное электромагнитное поле или столкновение с другими частицами |
Квантовые числа и энергия электрона
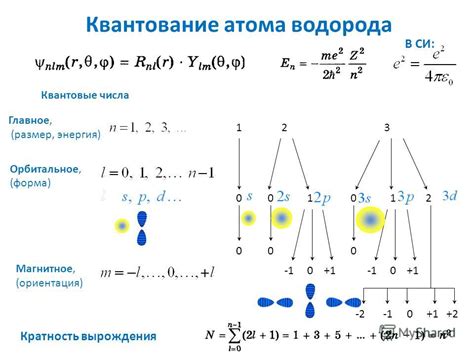
Квантовые числа играют важную роль в определении энергии электрона в атоме. Эти числа описывают различные характеристики орбитали, на которой находится электрон, и помогают определить его энергетическое состояние.
Первое квантовое число - главное квантовое число (n) - определяет основной энергетический уровень атома. Чем больше это число, тем выше энергия электрона. Каждому значению n соответствует своя орбиталь, которая окружает ядро атома.
Второе квантовое число - орбитальное квантовое число (l) - определяет форму орбитали электрона. Оно может принимать значения от 0 до (n-1). Каждому значению l соответствует своя форма орбитали, например, s, p, d или f.
Третье квантовое число - магнитное квантовое число (m) - определяет ориентацию орбитали в пространстве относительно внешнего магнитного поля. Оно может принимать значения от -l до l.
Наконец, четвертое квантовое число - спиновое квантовое число (s) - определяет спин электрона. Оно может принимать значения 1/2 или -1/2. Спин электрона также влияет на его энергию в атоме.
Все эти квантовые числа взаимодействуют между собой и определяют энергию электрона в атоме. Знание этих чисел позволяет предсказывать различные характеристики атома и его энергетическое состояние.



