Раствор серной кислоты – это одно из наиболее известных и распространенных химических соединений. Его свойства и процессы, происходящие во время взаимодействия с другими веществами, являются предметом изучения многих ученых. Большинство из нас привыкли представлять серную кислоту как очень агрессивное вещество, способное вызвать серьезные ожоги и нанести вред окружающей среде. Однако, несмотря на свою опасность, раствор серной кислоты обладает некоторыми удивительными особенностями.
Во время взаимодействия серной кислоты с веществами, отдельные химические процессы могут быть отсутствующими. Например, раствор серной кислоты обладает уникальными свойствами, такими как отсутствие окислительной реакции. При обычных условиях серная кислота не обладает способностью окислять другие вещества, что является необычной особенностью для кислоты. Это делает раствор серной кислоты безопасным для некоторых химических процессов, требующих удаления окисленных частиц или сохранения веществ в их исходном состоянии.
Также, стоит отметить, что раствор серной кислоты не обладает способностью образовывать газы при взаимодействии с другими веществами. Это значит, что при растворении серной кислоты в воде, в отличие от некоторых других кислот, таких как соляная кислота или уксусная кислота, не выделяется углекислый газ, который способен причинить вред окружающей среде или спровоцировать реакцию образования тумана. Такая особенность делает раствор серной кислоты более удобным в использовании в различных промышленных и лабораторных процессах.
Отсутствие озонирования раствора серной кислоты

Озонирование раствора серной кислоты может быть отсутствующим из-за нескольких факторов.
Во-первых, озон очень реакционна молекула, которая легко разлагается при взаимодействии с различными веществами. Раствор серной кислоты может содержать примеси или другие соединения, которые делают его несовместимым с озонированием. Например, органические вещества, присутствующие в растворе, могут реагировать с озоном и нейтрализовать его действие.
Во-вторых, pH раствора серной кислоты может быть выше или ниже оптимального уровня для озонирования. Оптимальный pH обычно находится в диапазоне от 4 до 7. Если pH раствора выходит за этот диапазон, процесс озонирования может быть затруднен или даже невозможен. Высокий уровень кислотности или щелочности раствора может изменить состояние озона и привести к его разложению.
Кроме того, температура раствора серной кислоты может оказывать влияние на его способность к озонированию. Высокая температура может ускорить разложение озона и затруднить процесс озонирования. Низкая температура, с другой стороны, может замедлить реакцию озона с раствором.
Важно учитывать все эти факторы при планировании озонирования раствора серной кислоты, чтобы достичь желаемых результатов. Тщательное контролирование условий реакции может помочь избежать отсутствия озонирования и достичь оптимальных условий для применения этого процесса.
Поведение серной кислоты в присутствии органических веществ
Одной из особенностей взаимодействия серной кислоты с органическими веществами является возможность прохождения электрофильной атаки. Серная кислота, обладая сильным электрофильным характером, может атаковать атомы водорода в молекуле органического соединения, образуя с ними водородные связи и приводя к образованию производных.
Также стоит отметить, что в присутствии органических веществ реакция дегидратации, обычно характерная для серной кислоты, может проходить менее интенсивно. Это связано с тем, что органические соединения могут уменьшить активность протонов серной кислоты и тем самым затормозить процесс дегидратации.
Однако следует отметить, что не все органические вещества могут быть стабильными в присутствии серной кислоты. Некоторые соединения могут быть разрушены или подвергаться другим реакциям, связанными с потерей функциональных групп или образованием новых соединений.
Таким образом, поведение серной кислоты в присутствии органических веществ имеет свои особенности, которые определяются структурой и свойствами данных соединений.
Влияние присутствия ионов металлов на реакцию серной кислоты
Одним из факторов, влияющих на реакцию серной кислоты, является присутствие ионов металлов в реакционной среде. Металлы могут выполнять различные роли в ходе реакции.
Во-первых, металлы могут быть катализаторами реакции серной кислоты. Они способны активировать молекулы серной кислоты и ускорять процесс образования ионов гидрогена (H+) и сульфата (SO42-). Катализаторы могут увеличить эффективность реакции и снизить энергию активации.
Во-вторых, металлы могут формировать соли с серной кислотой и изменять равновесие реакции. Например, при реакции серной кислоты с медными ионами (Cu2+), образуются сульфат меди (CuSO4) и ионы водорода. Формирование солей с различными металлами может существенно изменить химическое равновесие и скорость реакции.
И, наконец, металлы могут взаимодействовать с продуктами реакции, осаждаясь на поверхности и препятствуя дальнейшей реакции. Например, при реакции серной кислоты с железными ионами (Fe3+), образуются сульфат железа (Fe2(SO4)3) и ионы водорода. Отложение железа на поверхности может замедлить или полностью прекратить реакцию.
| Ионы металлов | Роль в реакции серной кислоты |
|---|---|
| Катализаторы | Активируют молекулы серной кислоты и ускоряют реакцию |
| Соли | Формируют соли и изменяют равновесие реакции |
| Отложение на поверхности | Мешает дальнейшей реакции и замедляет ее |
Отсутствие полярности в молекулах серной кислоты
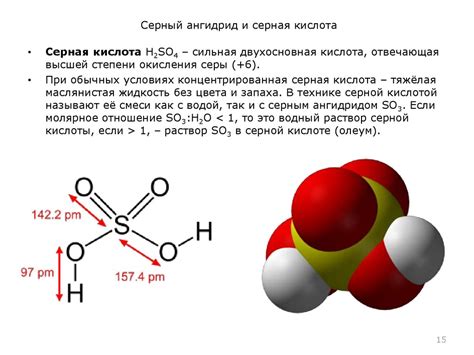
Молекулы серной кислоты (H2SO4) не обладают полярностью, что влияет на их реакционную способность. Под полярностью понимается асимметричность распределения общего отрицательного и положительного зарядов в молекуле.
В случае серной кислоты, каждый из атомов кислорода (O) образует две σ-связи с атомами водорода (H) и две тройные σ-связи с атомами серы (S). Это расположение атомов в молекуле создает симметричную структуру, что приводит к отсутствию разделения зарядов.
Полярные молекулы могут взаимодействовать с полярными растворителями и другими полярными молекулами путем образования водородных связей или электростатических сил притяжения. Однако в случае серной кислоты, отсутствие полярности затрудняет ее растворение в полярных растворителях и взаимодействие с другими полярными соединениями.
Также, отсутствие полярности в молекулах серной кислоты влияет на ее кислотность. Кислотность зависит от способности молекулы отдавать протоны (H+) другим веществам. Полярные молекулы, такие как HCl или H2O, образуют полярные водородные связи и легко отдают протоны. В случае серной кислоты, отсутствие полярности снижает ее способность отдавать протоны и тем самым влияет на ее кислотные свойства.
Таким образом, отсутствие полярности в молекулах серной кислоты оказывает влияние на их реакционную способность, растворимость и кислотные свойства.



