Кислород и водород - два важнейших химических элемента, которые находятся в составе воды, а также в большом количестве других соединений, необходимых для поддержания жизни на Земле. Их взаимодействие, хотя и безмолвное и незаметное, играет огромную роль во многих химических процессах.
Кислород - это газ без цвета, запаха и вкуса, который составляет около 21% атмосферы Земли. Он является основным источником энергии для существования множества организмов и сыграл решающую роль в эволюции жизни на нашей планете. Водород, в свою очередь, является самым легким и самым распространенным химическим элементом во Вселенной. Он может существовать в трех агрегатных состояниях: газообразном, жидком и твердом.
Когда кислород и водород сочетаются в определенных условиях, происходит реакция, результатом которой является образование нового вещества - воды. Эта реакция называется водородной окислением. Она является очень энергичной и происходит с выделением большого количества тепла и света. Водород загорается в присутствии кислорода, и на небе появляется красивое пламя. Таким образом, реакция между кислородом и водородом может использоваться в различных областях, включая промышленность, космическую технологию и энергетику.
Реакция кислорода и водорода
Когда кислород и водород соединяются, происходит химическая реакция называемая взаимодействием водорода и кислорода.
Основная реакция между кислородом и водородом – это горение водорода в присутствии кислорода.
Реакцию горения водорода можно представить в виде химического уравнения:
- 2H2 + O2 → 2H2O
При этой реакции образуется вода - основной продукт реакции.
Следует отметить, что реакция горения водорода с кислородом является экзотермической - она выделяет тепло.
Также в горении водорода образуется водяной пар, который является невидимым, но значительно расширяется в объеме, что вызывает появление видимой милицзы.
Кроме того, возможны другие реакции между кислородом и водородом, например, взаимодействие водорода и кислорода при каталитическом окислении:
- 2H2 + O2 → 2H2O при наличии катализатора
Такие реакции также используются в промышленности и научных исследованиях для создания различных веществ и материалов.
Химические свойства кислорода и водорода

Кислород образует двухатомные молекулы, обозначаемые как O2. Они являются бесцветным и безвкусным газом, который составляет около 20% атмосферы Земли.
Кислород проявляет свои окислительные свойства при взаимодействии с другими веществами. Например, он способен окислять металлы, образуя оксиды. Этот процесс называется окислением. Кислород также играет важную роль в горении и дыхании.
Водород – самый легкий элемент в периодической системе и по своим химическим свойствам схож с галогенами. Он обладает наибольшей электроотрицательностью из всех элементов, что делает его хорошим восстановителем.
Водород образует одноатомные молекулы, обозначаемые H2. В природе большую часть времени он находится в связанном состоянии, например, воде (H2O) или органических соединениях.
Водород является отличным топливом и используется в процессе водородной энергетики. Он также широко применяется в процессах химических реакций, таких как гидрирование и синтез различных соединений.
Окислительные свойства кислорода и восстановительные свойства водорода

Окислительные свойства кислорода определяются его высокой электроотрицательностью. Кислород может отбирать электроны от других веществ, что приводит к окислению данных веществ. Примером такой реакции является горение. Во время горения кислород соединяется с другими элементами, выделяя большое количество тепла и энергии.
Водород, в свою очередь, обладает восстановительными свойствами. Он может отдавать свои электроны и восстанавливать окисленные вещества. Это происходит, когда водород вступает в реакцию с другими элементами, передавая им свои электроны и снижая свою степень окисления.
Окислительные свойства кислорода и восстановительные свойства водорода являются ключевыми во многих химических процессах. Они присутствуют в аэробных процессах дыхания организмов, горении и многих других важных процессах, происходящих в природе и промышленности.
Кислород и водород - два важных химических элемента, которые играют непосредственную роль в множестве окислительно-восстановительных реакций. Сочетание их свойств помогает поддерживать химическое равновесие в природе и обеспечивает энергию для жизнедеятельности организмов.
Способы получения кислорода и водорода
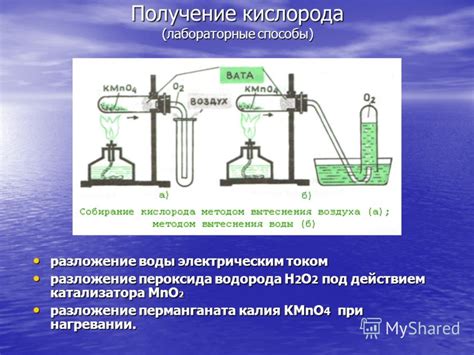
1. Электролиз воды
Один из самых распространенных способов получения водорода и кислорода - это электролиз воды. При этом методе вода разлагается на кислород и водород с использованием электрического тока. Катод приводится в восстановительное состояние, что позволяет получить водород, а на аноде окислительное состояние формирует кислород.
2. Термическое разложение воды
Другой способ получения водорода - это термическое разложение воды. При этом методе вода нагревается до высокой температуры, что приводит к ее разложению на водород и кислород. Этот метод требует высоких энергетических затрат и не является эффективным с точки зрения экономии ресурсов.
3. Реакция металлов с кислородом
Кислород можно получить путем реакции некоторых металлов с кислородом. Например, окисление металлического калия или натрия в атмосфере кислорода приводит к образованию соответствующих оксидов металла и выделению кислорода.
4. Фотохимическое разложение воды
Фотохимическое разложение воды - это процесс, при котором свет используется для разделения воды на водород и кислород. Фотолиз воды может происходить при наличии определенного типа фотокатализатора, который помогает преодолеть энергетический барьер для разложения воды.
5. Химические реакции
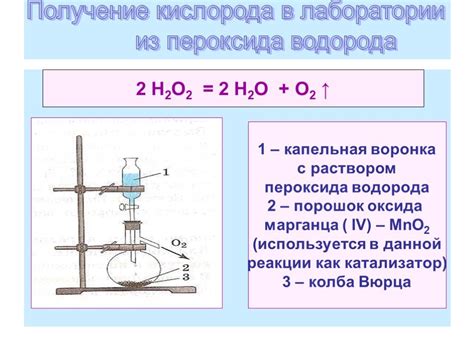
Некоторые химические реакции также могут способствовать получению водорода и кислорода. Например, пероксид водорода (водородный пероксид) может разлагаться на воду и кислород в присутствии катализатора.
| Метод получения | Реакция |
|---|---|
| Электролиз воды | 2H2O(l) -> 2H2(g) + O2(g) |
| Термическое разложение воды | 2H2O(l) -> 2H2(g) + O2(g) |
| Реакция металлов с кислородом | 2Na(s) + 1/2O2(g) -> Na2O(s) |
| Фотохимическое разложение воды | 2H2O(l) -> 2H2(g) + O2(g) |
| Химические реакции | H2O2(aq) -> H2O(l) + 1/2O2(g) |
Применение кислорода и водорода

Один из основных способов использования кислорода - дыхание. Он необходим нашему организму для поддержания жизни, так как задействован в клеточном дыхании, где происходит процесс окисления органических веществ с образованием энергии.
Водород также находит широкое применение. Он используется в промышленности для производства веществ, таких как аммиак, метанол и ряда органических соединений. Водород является важным компонентом при производстве различных материалов, включая пластик и стекло. Он также используется в качестве ракетного топлива и может быть использован в батареях.
Кислород находит применение в медицине: его используют для лечения различных заболеваний, включая респираторный дистресс-синдром и раны, которые трудно заживают. Кислород также используется в качестве окислителя в множестве химических процессов и производстве стекла, металлов и других веществ.
Использование кислорода и водорода в различных отраслях нашей жизни подчеркивает их важность и необходимость в обеспечении нормального функционирования организмов и производства различных товаров и услуг.
Реакции кислорода и водорода с другими веществами

| Вещество | Реакция с кислородом | Реакция с водородом |
|---|---|---|
| Углерод | Образование углекислого газа при сжигании | Не вступает в реакцию с водородом |
| Железо | Образование оксида железа (ржавчины) | Не вступает в реакцию с водородом |
| Сера | Образование диоксида серы при сгорании | Не вступает в реакцию с водородом |
| Алюминий | Образование оксида алюминия | Не вступает в реакцию с водородом |
| Натрий | Образование оксида натрия | Не вступает в реакцию с водородом |
Кислород и водород также могут реагировать между собой, образуя воду. Эта реакция является одной из наиболее фундаментальных в химии и важной для жизни на Земле.
Практическое значение реакции кислорода и водорода

Одним из основных примеров практического использования реакции кислорода и водорода является процесс кислородной сварки. При этом процессе водород и кислород реагируют при высокой температуре, образуя воду и выделяя большое количество тепла. Это позволяет связать и запаять металлические детали и конструкции.
Реакция кислорода и водорода также используется в производстве водорода в промышленных масштабах. Водород является важным сырьем для производства аммиака, металлов и других промышленных продуктов. Реакция кислорода и водорода в этом случае протекает в присутствии специальных катализаторов.
Кроме того, реакция кислорода и водорода играет ключевую роль в зажигании двигателей внутреннего сгорания. Водород, смешиваясь с кислородом, взрывается и образует высокоэнергетическую смесь, способную приводить в движение поршни двигателей и автомобилей.
Таким образом, реакция кислорода и водорода имеет широкое практическое значение и находит применение в различных отраслях науки и промышленности. Эта реакция позволяет связывать и создавать новые вещества, обеспечивать энергией и двигать машины, а также производить различные химические продукты. Без этой реакции наша техника и промышленность были бы значительно ограничены и не смогли бы развиваться.



