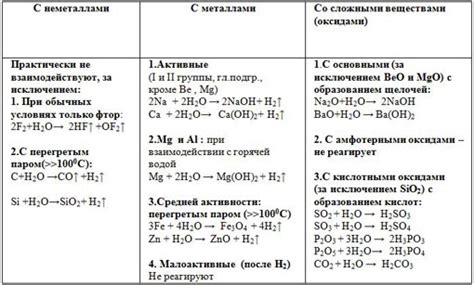
Барий – химический элемент, относящийся к щелочноземельным металлам. Он широко используется в различных отраслях промышленности, таких как производство стекла, нефтепродуктов, краски и других химических соединений. Барий обладает высокой плотностью и является отличным рентгенконтрастным веществом, что делает его незаменимым в медицинской диагностике.
Одной из самых интересных особенностей бария является его реакция с водой. При контакте с водой, барий проявляет высокую реактивность, и процесс взаимодействия сопровождается различными химическими реакциями и выделением газов.
В результате взаимодействия бария и воды, образуется гидроксид бария – сильная щелочь, которая хорошо растворима в воде. При этом выделяется водород – легковоспламеняющийся газ, который может воспламениться под воздействием огня или искры.
Взаимодействие бария и воды: химические реакции и их последствия
Когда барий попадает в воду, протекает химическая реакция, в результате которой образуется барий гидроксид (Ba(OH)2) и выделяется водород (H2). Реакция проходит таким образом:
Ba + H2O → Ba(OH)2 + H2
Образовавшийся барий гидроксид является щелочной солью, которая растворяется в воде с образованием гидроксидных и ионов бария. Такая реакция является экзотермической, то есть сопровождается выделением тепла.
Взаимодействие бария и воды также может привести к образованию бария гидроксида (Ba(OH)2) в виде осадка. Это наблюдается в случае, если реакция проходит медленно, когда вода находится в ограниченном доступе или при высоких концентрациях бария. Образовавшийся осадок является твёрдым, белым веществом.
Взаимодействие бария и воды имеет некоторые опасности. Барий является токсичным для организмов, поэтому при неправильном обращении с ним возможно отравление.
Реакция бария с водой: основные характеристики

Основные характеристики реакции бария с водой:
| Характеристика | Описание |
|---|---|
| Экзотермическая реакция | Реакция бария с водой сопровождается выделением большого количества тепла, что приводит к резкому повышению температуры и даже возможному воспламенению водорода. |
| Высвобождение водорода | В результате реакции образуется значительное количество газообразного водорода, который может собираться и использоваться в качестве энергетического источника. |
| Гидроксид бария | По химической формуле Ba(OH)2 образуется гидроксид бария, который представляет собой белый кристаллический порошок и обладает высокой щелочной активностью. |
| Опасность взаимодействия | Взаимодействие бария с водой является опасным и требует строгого соблюдения мер безопасности, включая работу в специально оборудованных лабораториях и использование защитного снаряжения. |
Реакция бария с водой важна как академический объект изучения химии, а также имеет промышленное применение в процессах производства гидроксида бария и водорода.
Гашение бария: важный этап реакции

В случае гашения бария физико-химический процесс состоит в образовании нерастворимого вещества – гидроксида бария (Ba(OH)2). Гидроксид бария образуется в результате реакции между раствором бария (Ba) и водой (H2O). Во время реакции происходит замещение водорода в молекуле воды остатком бария:
- Ba + 2H2O → Ba(OH)2 + H2
Образующийся гидроксид бария – нерастворимое вещество, то есть оно практически не растворяется в воде. Это свойство является ключевым при гашении бария, так как именно гидроксид бария оседает в осадок, прекращая дальнейшую реакцию.
Гидроксид бария, оседая на дне емкости, образует осадок белого цвета и имеет химическую формулу Ba(OH)2. Он обладает высокой щелочностью и разлагается при нагревании, образуя барийт (BaO) и воду:
- Ba(OH)2 → BaO + H2O
Гашение бария является важным этапом при взаимодействии бария и воды, так как позволяет снизить активность процесса и управлять ходом реакции. Этот процесс также замедляет образование газообразных продуктов, что делает его безопасным.
Образование гидроксида бария: продукт реакции
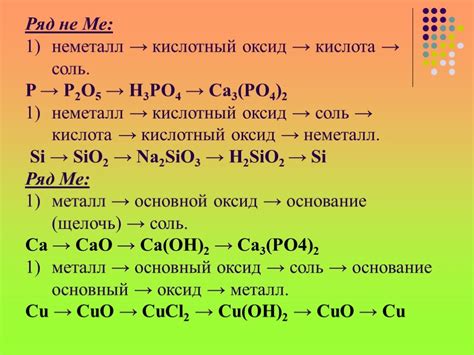
Реакция начинается с того, что барий с реагентом – водой, вступает в контакт. При этом между атомами бария и молекулами воды происходит обмен протонами, что ведет к разрыву связей и образованию новых соединений.
Образовавшийся гидроксид бария является сильной щелочной солью. Он обладает высокой растворимостью в воде, что позволяет ему прекрасно диссоциироваться и образовывать ионы гидроксида (Ba2+ и 2OH-). Ионы гидроксида обладают амфотерными свойствами и способны реагировать с разными кислотными и основными веществами.
Гидроксид бария широко применяется в различных отраслях промышленности, в том числе в производстве стекла, эмалей, керамики и медицинских препаратов.
Барий и образование плотного осадка: химические свойства

При контакте бария с водой происходит достаточно живое химическое взаимодействие, в результате которого образуется плотный осадок – гидроксид бария (Ba(OH)2). Образование осадка происходит в соответствии с реакцией:
Ba + 2H2O → Ba(OH)2 + H2
Эта реакция является экзотермической и выделяет большое количество тепла. Частичное растворение бария в воде также приводит к образованию щелочного раствора с повышенной щелочностью.
Гидроксид бария, образуя плотный осадок, обладает высокой плотностью и исключает растворение бария из воды. Поэтому эту реакцию можно использовать в лабораторных условиях для выделения бария из растворов, содержащих этот элемент.
Важно отметить, что барий является тяжелым металлом и относится к токсичным веществам. Поэтому при работе с ним необходимо соблюдать предосторожность и использовать защитное снаряжение.
Опасность и предостережения при работе с барием

- Используйте перчатки, защитные очки и защитную одежду при работе с барием, чтобы предотвратить контакт с кожей, глазами и другими частями тела.
- При работе с барием необходимо обеспечить хорошую вентиляцию, чтобы предотвратить вдыхание паров и пыли.
- Избегайте случайного проглатывания бария или попадания его в пищеварительную систему.
- Храните барий в хорошо закрытых контейнерах, вдали от прямого солнечного света и влаги.
- При возникновении симптомов отравления (включая головную боль, тошноту, рвоту, расстройства желудка) немедленно прекратите работу и обратитесь к врачу.
Необходимо учесть, что барий является веществом, которое может быть опасным, если не соблюдаются правила безопасности. Поэтому очень важно быть осторожным и следовать предостережениям при работе с этим веществом.
Практическое применение взаимодействия бария и воды

Одним из наиболее распространенных применений взаимодействия бария и воды является его использование в медицине. Барий используется для проведения рентгеновских исследований пищевода, желудка и кишечника. После приема раствора бария пациентам делают серию рентгенографий, чтобы проверить состояние этих органов. Барий позволяет получить детальные изображения, благодаря своей способности пропускать рентгеновское излучение.
Другим практическим применением взаимодействия бария и воды является его использование в процессе очистки нефти. Барийсодержащие соединения добавляют в нефтяные скважины, чтобы улучшить процесс добычи нефти. Они способны образовывать стабильные эмульсии между нефтью и водой, что помогает улучшить разделение этих двух фаз и повысить эффективность добычи.
Барий также находит применение в производстве стекла, фармацевтической и косметической промышленности, синтезе органических соединений, а также в процессе производства огнеупорных материалов.
В целом, взаимодействие бария и воды имеет широкий спектр практического применения, от медицинских исследований до производства различных материалов. Это подтверждает важность и значимость этого химического процесса в различных отраслях нашей жизни.



