Карбонат кальция – это химическое соединение, которое часто встречается в природе в виде минерала кальцита. Этот минерал широко используется в строительстве, медицине и пищевой промышленности. Однако, при нагревании карбонат кальция происходит его распад, что вызывает интерес у ученых и промышленников.
При нагревании карбонат кальция происходит две основные реакции. Первая реакция – это термическое разложение карбоната кальция на оксид кальция и углекислый газ. Формула реакции выглядит следующим образом:
CaCO3 → CaO + CO2
Углекислый газ, или двуокись углерода, выделяется в виде газа, а оксид кальция остается в виде твердого вещества. Таким образом, при нагревании карбонат кальция происходит его декомпозиция на два различных вещества.
Распад карбоната кальция при нагревании
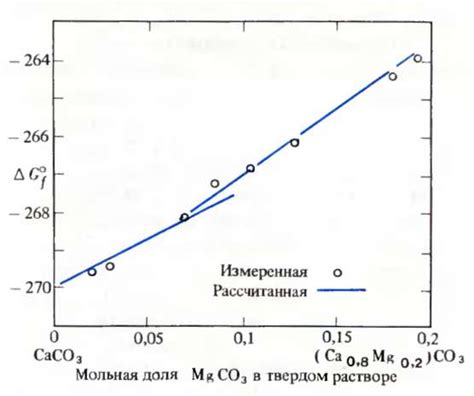
При нагревании карбонат кальция происходит его термический распад на два продукта - оксид кальция (CaO) и углекислый газ (CO2). Реакция может быть записана следующим образом:
| Реакция | Уравнение |
|---|---|
| Распад карбоната кальция | CaCO3 → CaO + CO2 |
Эта реакция является эндотермической, то есть для ее осуществления требуется поступление тепла. По мере нагревания карбоната кальция начинается выделение углекислого газа, который приводит к пузырьковому кипению сопровождающемуся образованием чистого оксида кальция.
Данная реакция широко используется в промышленности, например, в процессе производства цемента. Также распад карбоната кальция при нагревании является одним из важных физических явлений, определяющих особенности формирования и изменения природных ландшафтов и горных пород.
Общая информация о карбонате кальция
В природе карбонат кальция представлен различными формами: известняком, мрамором и арагонитом. Он обладает белым или бесцветным цветом, а его кристаллическая структура обычно имеет вид субмикроскопических пластин или призматических кристаллов.
Карбонат кальция является не только важным минералом, но и неорганической соединительной тканью для животных, так как он содержится в костях, зубах и раковинах. Он также используется в производстве многих товаров, включая карбонатные напитки, меловую пасту, кальциевые добавки и косметические продукты.
Тепловое разложение карбоната кальция

Процесс теплового разложения карбоната кальция может быть описан следующей химической реакцией:
CaCO3 → CaO + CO2
При нагревании карбонат кальция до температуры около 900 °C происходит распад карбоната на оксид кальция и углекислый газ. Реакция сопровождается поглощением тепла, и поэтому является эндотермической.
Образованный оксид кальция (известь) может использоваться в различных отраслях промышленности, например, для производства цемента. Углекислый газ, выделяющийся в результате реакции, также может быть использован в различных технологических процессах, например, в пищевой и газовой промышленности.
Таким образом, тепловое разложение карбоната кальция является важной реакцией, которая имеет широкое применение в различных отраслях промышленности.
Образование оксида кальция при нагревании карбоната

Формула карбоната кальция CaCO3 указывает на то, что он состоит из иона кальция (СаО) и ионов карбоната (СО32-). Под действием высокой температуры, молекулы карбоната кальция начинают разлагаться, причем образуется оксид кальция (СаО) и углекислый газ (СО2).
Реакция выглядит следующим образом:
CaCO3 → CaO + CO2
Оксид кальция (СаО), или известь, имеет белый цвет и является твердым веществом. Он обладает высокой термической стабильностью и широко используется в различных отраслях промышленности, таких как строительство, стекольная промышленность и производство цемента.
Углекислый газ (СО2) является одним из главных парниковых газов и является продуктом сгорания органических топлив. Он используется в пищевой промышленности для создания газообразной среды, а также в производстве содовой. Выделение углекислого газа при нагревании карбоната кальция является одним из методов получения этого вещества.
Выделение углекислого газа при нагревании карбоната

Реакция декомпозиции карбоната кальция с применением тепла выглядит следующим образом:
CaCO3 → CaO + CO2
То есть, под воздействием высокой температуры, карбонат кальция распадается на оксид кальция (известняк) и углекислый газ. Углекислый газ выделяется в виде газовых пузырьков и может быть собран и использован в различных технических и промышленных процессах, включая производство газированных напитков, карбонизацию пива и другие цели.
Данная реакция особенно важна в геологических и геохимических процессах, так как карбонат кальция широко распространен в природе и его декомпозиция играет важную роль в круговороте углерода в биосфере. Выделение углекислого газа при нагревании карбоната кальция является одним из способов, которыми углерод из земной коры и песчаников может попасть в атмосферу и участвовать в глобальном углеродном цикле.
Явление пятнистых дефектов при разложении карбоната

При нагревании карбоната кальция может наблюдаться явление пятнистых дефектов.
Пятнистые дефекты возникают из-за неоднородного разложения карбоната кальция при нагревании, что приводит к образованию неравномерных пятен на поверхности.
Эти пятнистые дефекты могут быть вызваны различными факторами, такими как неравномерное распределение температуры внутри образца, различные скорости разложения карбоната на разных участках и наличие примесей в исходном образце.
При разложении карбоната кальция образуются оксид и углекислый газ:
- CaCO3 → CaO + CO2
Пятнистые дефекты могут быть видны невооруженным глазом или под микроскопом и имеют неправильную форму и цвет. Это может негативно сказаться на внешнем виде материала, особенно если он используется в декоративных целях.
Для получения качественного карбоната кальция без пятнистых дефектов необходимо контролировать условия нагревания и процесс разложения, а также обратить внимание на качество исходного образца.
Влияние температуры на скорость разложения карбоната

При нагревании карбонат кальция происходит разложение на два компонента - оксид кальция (CaO) и углекислый газ (CO2). Это окислительно-восстановительная реакция, которая протекает в соответствии со следующим уравнением:
CaCO3 -> CaO + CO2
Температура играет важную роль в этом процессе. Чем выше температура, тем быстрее происходит разложение карбоната кальция. При комнатной температуре разложение происходит очень медленно и может занимать длительное время.
Однако при нагревании карбоната кальция до температуры порядка 800 °C происходит значительное ускорение этой реакции. Это связано с повышением энергии теплового движения частиц, что способствует их более активному столкновению и переходу в более высокоэнергетическое состояние.
Кроме того, увеличение температуры приводит к увеличению давления паров углекислого газа, что способствует более интенсивному выделению газа из карбоната кальция.
Использование полученных продуктов разложения карбоната

Распад карбоната кальция при нагревании приводит к образованию оксида кальция (известняка) и выделению углекислого газа. Оба этих продукта имеют различные применения и широко используются в различных отраслях промышленности и повседневной жизни.
Оксид кальция (известняк) – это основное соединение кальция, которое широко применяется в строительстве, производстве стекла, производстве цемента и известковом производстве. Известняк используется для изготовления сульфатно-алюминиевого клея, мела для животных, воды для подавления пыли на дорогах, очистки и умягчения воды.
Выделенный углекислый газ (диоксид углерода) также находит широкое применение в различных отраслях. Он используется в пищевой промышленности для напитко- и кондитерской продукции, а также для создания газированных напитков. Углекислый газ используется в медицине для проведения газовых обменов, в химической промышленности в качестве сырья для производства различных химических соединений и в индустрии для создания снежного эффекта на праздничных украшениях.



