Каждый атом состоит из ядра и облака электронов, и важно понимать, как электроны распределяются вокруг ядра. Неспаренные электроны - это электроны, которые находятся в орбиталях, не занятых парами других электронов.
Рассчитать число неспаренных электронов в атоме можно с помощью так называемого "правила Хунда". Это правило гласит, что электроны начинают занимать орбитали с низшей энергией, и заполняют каждую орбиталь по одному электрону до тех пор, пока все орбитали не будут заполнены по одному электрону. Затем электроны начинают заполнять орбитали парами.
Чтобы рассчитать число неспаренных электронов в атоме, нужно знать его электронную конфигурацию, то есть распределение электронов по энергетическим уровням и подуровням. Запись электронной конфигурации происходит по следующему правилу: первый числовой индекс равен номеру энергетического уровня (1, 2, 3 и т.д.), второй индекс - номеру подуровня (s, p, d, f), и число внизу - количество электронов на данном подуровне.
Число неспаренных электронов в атоме
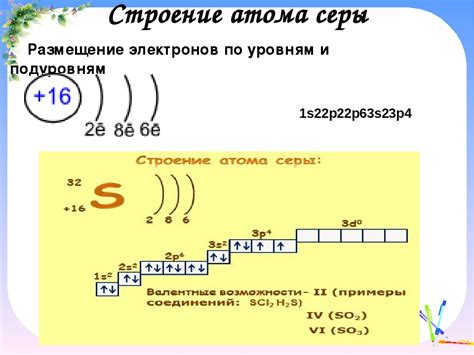
Для определения числа неспаренных электронов в атоме можно использовать правило Хунда. Согласно этому правилу, электроны сначала заполняют нижние энергетические орбитали, а затем постепенно переходят на более высокие энергетические уровни. При заполнении орбиталей одного энергетического уровня электроны предпочитают находиться в отдельных орбиталях, а не образовывать пару с другим электроном.
Например, для атома кислорода (O) с 8 электронами общей валентной оболочки, число неспаренных электронов равно 2. Первые 6 электронов занимают орбитали с меньшей энергией, а оставшиеся два электрона находятся в отдельных орбиталях на более высоком энергетическом уровне.
Знание числа неспаренных электронов в атоме помогает предсказывать химические свойства и реакционную способность элемента. Неспаренные электроны могут участвовать в образовании химических связей и реагировать с другими атомами или молекулами.
Локализация неспаренных электронов в атоме позволяет определить его электронную конфигурацию и понять, как он взаимодействует с окружающими веществами. Это важная информация для понимания химического поведения элементов и разработки новых соединений с нужными свойствами.
Что такое неспаренные электроны?

Возникновение неспаренных электронов связано с особенностями распределения электронов в атоме. Каждая орбиталь может содержать не более двух электронов с противоположным спином. Если в орбиталь входит только один электрон, то он считается неспаренным. Неспаренные электроны часто обладают химической активностью и являются ключевыми участниками химических реакций.
Определение числа неспаренных электронов в атоме является важным шагом при изучении его химических свойств. Чаще всего для определения числа неспаренных электронов используют схему Хунда – рисунок, на котором обозначены все энергетические уровни и по которому происходит заполнение электронных орбиталей.
Как рассчитать число неспаренных электронов?
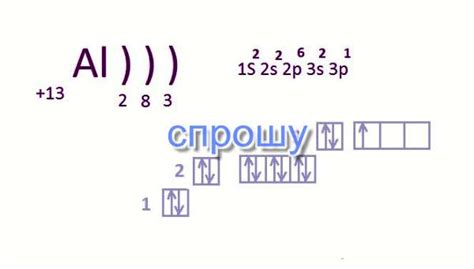
Число неспаренных электронов в атоме можно рассчитать на основе расположения электронов в энергетических уровнях атома. Неспаренные электроны представляют собой электроны, которые не образуют пару с другим электроном с противоположным спином в том же орбитале.
Для определения числа неспаренных электронов необходимо выполнить следующие шаги:
- Определите электронную конфигурацию атома. Это можно сделать путем заполнения энергетических уровней атома электронами в соответствии с принципом избегания повторения и принципом Гунда. Пример электронной конфигурации: 1s2 2s2 2p6 3s2 3p2.
- Определите последний заполненный энергетический уровень. Это будет наибольший номер энергетического уровня, на котором имеются электроны в электронной конфигурации.
- Определите число неспаренных электронов на последнем заполненном энергетическом уровне. Для этого посчитайте число электронов на этом уровне и вычтите из него число парных электронов (по два электрона в каждой орбитали).
Теперь, зная число неспаренных электронов, вы можете использовать эту информацию для определения свойств атома и его химического поведения.
Пример:
Для атома кислорода электронная конфигурация составляет 1s2 2s2 2p4. Последний заполненный энергетический уровень - 2р. На этом уровне есть 4 электрона. Из них двое образуют пару в орбитали 2px и двое образуют пару в орбитали 2py. Таким образом, на последнем заполненном энергетическом уровне кислорода есть 2 неспаренных электрона.
Итак, для рассчета числа неспаренных электронов в атоме, вы должны знать его электронную конфигурацию и последний заполненный энергетический уровень.



