Процесс распада электролита на ионы является основным механизмом передачи электричества в растворах. Электролиты представляют собой вещества, способные распадаться на положительно и отрицательно заряженные частицы - ионы. Этот процесс называется ионизацией.
В зависимости от типа электролита, процесс ионизации может происходить по-разному. В случае сильного электролита, такого как соляная кислота или соль, ионизация происходит полностью - все молекулы электролита распадаются на ионы. В случае слабого электролита, например уксусной кислоты, только небольшая часть молекул ионизируется.
Процесс ионизации достигает динамического равновесия, при котором скорость обратной реакции равна скорости прямой реакции. Это означает, что ионы, образующиеся в результате ионизации, могут взаимодействовать друг с другом, образуя молекулы исходного электролита.
Важно отметить, что процесс распада электролита на ионы играет ключевую роль в различных химических и биологических процессах, таких как проведение электричества в растворах, пищеварение, фотосинтез и другие. Понимание этого процесса позволяет лучше осознать многие явления, происходящие в природе и в химической промышленности.
Что происходит при распаде электролита?

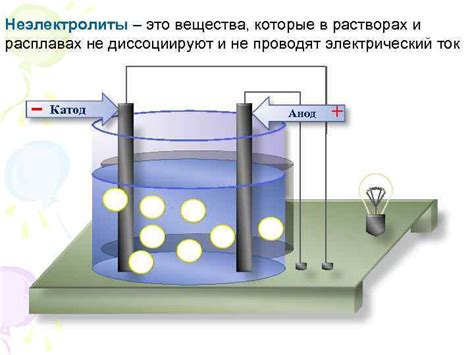
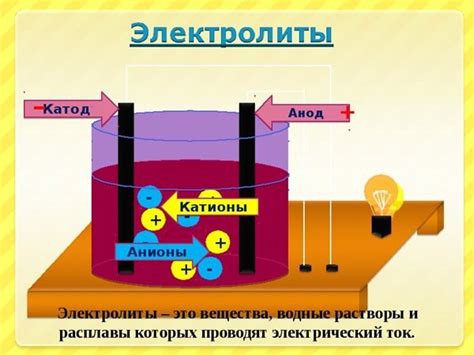
При распаде электролита положительные ионы, которые называются катионами, образуются на катоде электролита, а отрицательные ионы, называемые анионами, образуются на аноде. Катод и анод – это электроды, которые находятся в контакте с электролитом.
Положительный ион катода переходит к отрицательному электроду – аноду, в то время как отрицательный ион анода переходит к положительному электроду – катоду. Таким образом, происходит перемещение ионов из электролита на электроды.
Распад электролитов происходит благодаря проведению электрического тока через электролит. При подключении источника тока, например, батареи, ионы начинают двигаться под влиянием электрического поля, создаваемого источником тока.
Важно отметить, что электролиты, в отличие от нэлюедёных веществ, могут проводить электрический ток благодаря наличию свободных ионов. Распад электролита позволяет использовать электролиты в различных процессах, таких как электролиз, гальваническая и топливная ячейки, а также в биологии, фармакологии и других областях исследований.
| Катод | Анод |
|---|---|
| Место образования положительных ионов (катионов). | Место образования отрицательных ионов (анионов). |
| Положительный ион перемещается к аноду. | Отрицательный ион перемещается к катоду. |
Роль электролитов в химических реакциях
Электролиты играют важную роль в химических реакциях, так как они способны распадаться на ионы и обеспечивать проводимость электрического тока в растворах.
Электролиты могут быть разделены на две основные группы: сильные и слабые. Сильные электролиты распадаются полностью на ионы в растворе, в то время как слабые электролиты распадаются лишь частично.
В химических реакциях, электролиты могут выступать как реагенты, продукты или катализаторы. Они могут участвовать в различных типах реакций, таких как осаждение, нейтрализация, окисление-восстановление и других.
Осаждение - это процесс образования твердого осадка при взаимодействии двух или более реагентов в растворе. Осадок образуется при образовании нерастворимого соединения, которое выпадает в виде твердой фазы. В данном случае, электролит постепенно ожидает сосуществование самостоятельных близкородственных реализаций.
Нейтрализация - это реакция, при которой кислота и основание превращаются в соль и воду. В данном случае, электролиты играют роль реагентов, их ионы сливаются, образуя молекулы натрия, хлора и воду.
Окисление-восстановление - это реакция, при которой происходит передача электронов с одного вещества на другое. В данном случае, электролит может участвовать в качестве окислителя или восстановителя, активно передвигаясь между различными ионами.
Таким образом, электролиты играют важную роль в химических реакциях, обеспечивая проводимость электрического тока в растворах и участвуя в различных типах реакций. Понимание роли электролитов позволяет более глубоко изучить принципы химических реакций и их влияние на окружающую среду.
Как происходит распад электролитов на ионы?
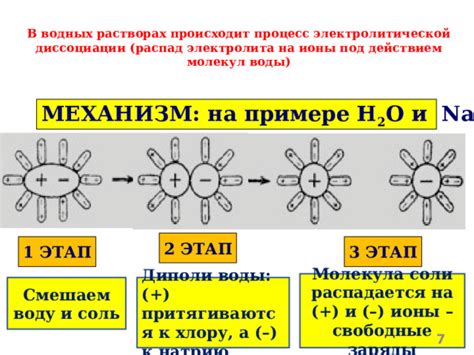
При растворении электролита в воде происходит процесс диссоциации. Молекулы электролита разделяются на положительно и отрицательно заряженные ионы. Положительно заряженные ионы называются катионами, а отрицательно заряженные ионы - анионами.
Диссоциация электролита происходит благодаря действию водных молекул. Ионизированные электролиты могут проводить электрический ток, так как положительно и отрицательно заряженные ионы могут перемещаться в растворе.
В электролитической ячейке при проведении электрического тока происходит процесс электролиза. Ионы электролита перемещаются к электродам под действием электрического поля. Положительно заряженные ионы (катионы) перемещаются к отрицательно заряженному электроду (катоду), а отрицательно заряженные ионы (анионы) перемещаются к положительно заряженному электроду (аноду). На электродах происходят реакции, связанные с переходом электронов, что приводит к образованию нейтральных веществ или вторичных реакций.
Распад электролитов на ионы имеет важное значение в различных химических процессах, таких как электрохимические реакции, растворение солей и проведение электрического тока в жидкостях.
Важность процесса распада электролита

Первое, на что следует обратить внимание, это то, что многие вещества, которые мы используем в повседневной жизни, являются электролитами. К примеру, соль, содa и кислоты - это электролиты, состоящие из ионов. Знание и понимание процесса распада электролита помогает нам более глубоко понять свойства этих веществ и их воздействие на нас.
Кроме того, процесс распада электролита является основой для работы многих важных технологий. Например, электролитический растворитель используется в процессе электролиза для разложения вещества на ионы и последующего получения различных продуктов. Электролитические процессы также играют важную роль в батареях и аккумуляторах, которые используются повсеместно в наших устройствах и технике.
Необходимо также отметить, что процесс распада электролита является ключевым для понимания многих химических реакций, происходящих в растворах. Распад электролита позволяет ученым и исследователям изучать многие аспекты химических процессов, в том числе кинетику, термодинамику и электрохимическое поведение.
Таким образом, понимание процесса распада электролита на ионы играет неотъемлемую роль в химии и науке в целом, а также имеет практическое применение в технологиях и процессах, влияющих на нашу жизнь.
Примеры распада электролитов
Распад электролитов на ионы может происходить с различной скоростью и в разных условиях. Давайте рассмотрим несколько примеров распада электролитов:
- Распад соли NaCl: молекула NaCl в водном растворе распадается на положительный ион натрия (Na+) и отрицательный ион хлора (Cl-). Этот процесс называется диссоциацией. В результате диссоциации образуется раствор с ионами Na+ и Cl-, которые могут свободно перемещаться в растворе.
- Распад кислоты HCl: кислота HCl также диссоциирует в водном растворе, образуя положительный ион водорода (H+) и отрицательный ион хлорида (Cl-). Это позволяет кислоте проявлять свои характерные кислотные свойства, такие как реакция с основаниями.
- Распад основания NaOH: основание NaOH также диссоциирует в водном растворе, образуя положительный ион натрия (Na+) и отрицательный ион гидроксида (OH-). Гидроксидные ионы OH- могут взаимодействовать с положительными ионами, образуя осадки или нейтрализуя кислотные ионы.
Приведенные примеры демонстрируют процесс распада электролитов на ионы и его значимость в химических реакциях и свойствах веществ. Распад электролитов помогает обеспечить электрическую проводимость растворов и играет важную роль в биологических процессах организма.



