В химии существует понятие координационной ненасыщенности атомов в соединениях, которое представляет собой способность атомов образовывать новые координационные связи с атомами других элементов. Эта особенность атомов вещества играет важную роль в химических реакциях и может оказывать значительное влияние на их свойства.
Координационная ненасыщенность атомов в соединениях обусловлена различными факторами. Во-первых, это может быть связано с электронной конфигурацией атомов. Некоторые атомы имеют неполностью заполненные энергетические уровни и стремятся к насыщению путем образования новых связей. Например, атомы семивалентных элементов, таких как фосфор или сера, имеют большую координационную ненасыщенность и могут образовывать до 6 связей с атомами других элементов.
Во-вторых, координационная ненасыщенность атомов может быть обусловлена их стерическими возможностями. Некоторые атомы имеют больший размер и, следовательно, большее количество валентных связей окружающих их атомов не поместится вокруг них. Это приводит к образованию не насыщенных связей и повышенной координационной ненасыщенности. Например, атомы серебра или золота имеют больший размер, поэтому способны образовывать множество связей с атомами других элементов.
Причины координационной ненасыщенности атомов в соединениях

Одним из основных факторов, определяющих координационную ненасыщенность атомов, является их электронная конфигурация. Если атом имеет недостаток электронов в своей внешней оболочке, он будет стремиться к образованию химических связей для того, чтобы заполнить свою электронную оболочку полностью. Таким образом, атомы становятся координационно ненасыщенными, когда необходимо образование новых связей для достижения насыщения.
Другой причиной координационной ненасыщенности атомов является их валентность. Валентность определяет количество химических связей, которые атом может образовать. Если валентность атома превышает количество доступных связей, то атом становится координационно ненасыщенным и имеет потребность в образовании дополнительных связей.
Также следует отметить, что координационная ненасыщенность может возникать в результате особенностей структуры и геометрии соединений. Например, молекулы сферической симметрии или молекулы с необычной геометрией могут иметь атомы, которые не могут образовать достаточное количество связей для насыщения своих электронных оболочек.
Зависимость от электронной конфигурации
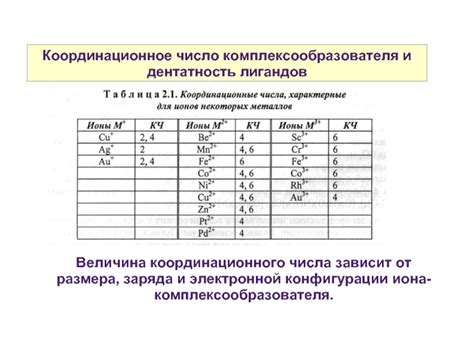
Координационная ненасыщенность атомов в соединениях зависит от их электронной конфигурации. Электронная конфигурация атома определяет его способность образовывать связи с другими атомами и составлять стабильные координационные соединения.
Атомы, имеющие неоконченные электронные оболочки, как правило, более склонны к образованию координационных соединений. Например, атомы металлов в переходных элементах имеют различные электронные конфигурации, которые часто содержат неспаренные электроны в своих d-орбиталях. Это делает их более наклонными к образованию связей с другими атомами и молекулами.
С другой стороны, атомы, имеющие заполненные электронные оболочки, могут быть менее склонны к образованию координационных соединений. Например, инертные газы, такие как гелий и неон, имеют полностью заполненные электронные оболочки и обычно не образуют координационных соединений.
Электронная конфигурация атома также может влиять на его способность принимать или отдавать электроны при образовании координационных связей. Атомы с высокой электроотрицательностью, как правило, имеют большую тенденцию принимать электроны и образовывать координационные связи с атомами с низкой электроотрицательностью.
| Атом | Электронная конфигурация | Координационная ненасыщенность |
|---|---|---|
| Fe | [Ar] 3d6 4s2 | Высокая |
| Zn | [Ar] 3d10 4s2 | Низкая |
| He | 1s2 | Отсутствует |
Таблица показывает примеры атомов с различными электронными конфигурациями и их уровнем координационной ненасыщенности. Атом железа (Fe) имеет неоконченные d-орбитали и, следовательно, высокую координационную ненасыщенность. Атом цинка (Zn), с другой стороны, имеет полностью заполненные d-орбитали и, следовательно, низкую координационную ненасыщенность. Инертные газы, такие как гелий (He), не имеют свободных электронов для образования координационных связей, поэтому их координационная ненасыщенность отсутствует.
Взаимодействие соседних атомов в полиэдрических комплексах

В полиэдрических комплексах, которые представляют собой структуры, состоящие из центрального атома, окруженного соседними атомами, наблюдается особое взаимодействие между атомами.
Это взаимодействие играет важную роль в обусловливании координационной ненасыщенности атомов в соединениях. Соседние атомы в полиэдрических комплексах могут быть лигандами, которые образуют связи с центральным атомом. Лиганды могут быть положительно или отрицательно заряженными, что влияет на силу взаимодействия.
Взаимодействие соседних атомов осуществляется через обмен электронами, что влияет на электронную структуру и химические свойства комплекса. Заряды соседних атомов, их размеры и формы, а также расстояния между атомами существенно влияют на энергию взаимодействия и стабильность соединения.
Соседние атомы в полиэдрических комплексах имеют склонность к образованию кластеров, что дополнительно увеличивает координационную ненасыщенность и влияет на химическую активность и структуру комплекса. Кластеры, образованные соседними атомами, могут быть неоднородными и обеспечивать различные свойства и функции комплекса.
Взаимодействие соседних атомов в полиэдрических комплексах имеет большое значение в координационной химии и является основным фактором, определяющим свойства соединений. Понимание этого взаимодействия позволяет разрабатывать новые соединения с нужными свойствами и применять их в различных областях науки и технологий.
| Молекула | Центральный атом | Соседние атомы |
|---|---|---|
| Хлорид никеля | Никель | Хлор |
| Аммиак | Азот | Водород |
| Цианоген | Углерод | Азот |
Эффект стерического отталкивания

Один из факторов, обуславливающих координационную ненасыщенность атомов в соединениях, это эффект стерического отталкивания. Стерическое отталкивание связано с пространственным расположением атомов и электронных облаков в молекуле или ионе.
Стерическое отталкивание возникает из-за наличия неподеленных электронных облаков, занимающих объем и противостоящих приближению других атомов. Это явление можно представить в виде отталкивания шаров. Если электронные облака двух атомов слишком близко соприкасаются, возникает отталкивающая сила, которая препятствует образованию или разрыву связи между атомами.
Стерическое отталкивание играет важную роль в химии, определяя структуру и свойства соединений. Оно может влиять на геометрию молекулы, размеры и форму молекулярных орбиталей, а также на способность молекулы или иона участвовать в химических реакциях.
Например, малые атомы часто имеют большую координационную ненасыщенность из-за своей способности образовывать ковалентные связи с несколькими атомами одновременно. Наоборот, большие атомы с их громоздкими электронными облаками могут испытывать большое стерическое отталкивание, что делает их менее способными к образованию связей.
Таким образом, понимание эффекта стерического отталкивания является важным для объяснения свойств и поведения различных соединений.
Влияние ионной радиуса и заряда на координационную ненасыщенность

Координационная ненасыщенность атомов в соединениях зависит от ряда факторов, включая ионный радиус и заряд. Ионный радиус определяется размером атома ионизированного элемента, а заряд определяет количество электронов, которые он принимает или отдает в процессе образования химической связи.
Ионный радиус играет важную роль в определении координационной ненасыщенности, так как он влияет на доступность различных сайтов для образования связей. Большие ионы имеют больший ионный радиус и могут связываться с большим количеством других атомов. Это может приводить к более сложным структурам соединений и более высокой степени координационной ненасыщенности.
Заряд атома также влияет на координационную ненасыщенность. Положительно заряженные ионы могут принимать электроны отрицательно заряженных ионов, что может приводить к образованию связей. Отрицательно заряженные ионы, напротив, могут отдавать электроны положительно заряженным ионам, также способствуя образованию связей. Если атом имеет большой заряд, то он может образовывать множество связей и иметь высокую координационную ненасыщенность.
Таким образом, ионный радиус и заряд играют важную роль в определении координационной ненасыщенности атомов в соединениях. Они определяют доступность различных сайтов для образования связей и количество связей, которые атом может образовывать.



