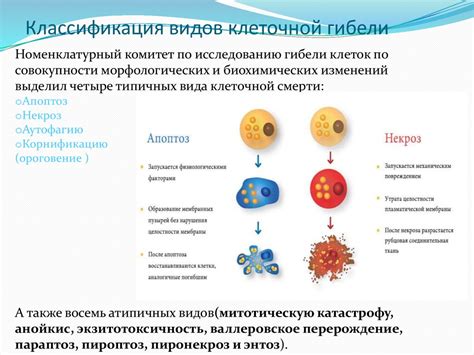
Программированная гибель клеток, также известная как апоптоз, является важным механизмом регуляции клеточного вырождения и устранения старых или поврежденных клеток. Этот процесс играет ключевую роль в различных биологических процессах, включая нормальное развитие организма, дифференциацию клеток, а также защиту от различных заболеваний, включая рак.
В аппарат апоптоза включено множество молекул и сигнальных путей, которые должны работать вместе для правильного управления клеточной гибелью. Определенные стимулы, такие как повреждения ДНК, недостаток питательных веществ или воздействие токсинов, могут запускать каскад протеолитических реакций, приводящих к фрагментации генома и снижению клеточного объема.
В ходе апоптоза клетка активирует программируемый процесс самоуничтожения и активно участвует в своей собственной гибели. Этот процесс контролируется специальными белками, которые находятся в клеточном цитозоле или на мембране внутренних органелл. Важную роль в апоптозе играют факторы роста, цитокины и гормоны, а также факторы внешней среды, такие как оксидативный стресс или низкий уровень кислорода.
Апоптоз является фундаментальным процессом, контролирующим баланс между клеточной вырождением и регенерацией организма. Расширенное понимание принципов и механизмов программированной гибели клеток может стать основой для разработки новых подходов в лечении различных заболеваний, включая рак и нейродегенеративные заболевания.
Программированная гибель клеток: роль и значение
Роль апоптоза состоит в том, чтобы избавить организм от поврежденных, излишних или не нужных клеток. Он активируется в различных ситуациях, таких как травмы, инфекции, раковые клетки и другие патологические состояния. Апоптоз обеспечивает эффективное удаление поврежденных клеток и предотвращает их размножение, что помогает поддерживать целостность организма и предотвращать развитие заболеваний.
Значение программированной гибели клеток в развитии организмов трудно переоценить. Он играет решающую роль в формировании и строении тканей и органов, а также в обновлении клеток и поддержании баланса в организме. Без апоптоза невозможно правильное функционирование и развитие организма.
В процессе апоптоза клетки программным образом активируют различные сигнальные пути и специфические гены, которые приводят к поэтапной разрушении клеток. Одним из ключевых событий в апоптозе является активация каскада каспаз, которые разрушают структуры в клетке, в том числе ядра и митохондрий.
Апоптоз также играет важную роль в регуляции генной экспрессии и контроле клеточного цикла. Он способствует удалению излишних или потенциально опасных клеток, предотвращая их не контролируемое размножение и возникновение рака. Благодаря этим механизмам, апоптоз играет решающую роль в здоровом функционировании организма.
Механизмы программированной гибели клеток: обзор
Существует несколько основных механизмов, которые контролируют программированную гибель клеток. Один из них - это активация каскада каспаз. Каспазы являются ферментами, которые активируются в ответ на различные сигналы и начинают разрушать структуру клетки. Каскад активации каспаз может быть инициирован различными сигнальными путями, такими как внутренний или внешний путь смерти. В результате, клетка проходит через несколько стадий апоптоза, включая сокращение клетки, конденсацию ядра и фрагментацию геномной ДНК.
Еще одним механизмом программированной гибели клеток является активация белков, известных как некрозисные факторы. Некрозисные факторы активируют некрозисные пути, которые приводят к гибели клеток путем неконтролируемого лизиса и воспалительной реакции. В отличие от апоптоза, некроз характеризуется нарушением целостности клетки и релизом в среду ее содержимого.
Программированная гибель клеток играет важную роль в различных физиологических процессах, таких как нормальная эмбриональная развитие, иммунная регуляция, удаление поврежденных клеток и контроль роста опухолей. Недостаточное или чрезмерное функционирование программированной гибели клеток может привести к различным патологическим состояниям, включая нейровоспаление, рак и автоиммунные заболевания.
| Механизм | Описание |
|---|---|
| Активация каскада каспаз | Активация ферментов каспаз, которые разрушают структуру клетки |
| Некрозисные факторы | Активация путей некроза, приводящих к неконтролируемому разрушению клетки |
Типы программированной гибели клеток: разнообразие
- Kлассический апоптоз: самый распространенный тип программированной гибели клеток, при котором клетки активно управляют своим собственным уничтожением. В этом случае клетки проходят последовательные фазы этапов апоптоза, сопровождающихся характерными морфологическими изменениями.
- Некрозозависимый апоптоз: происходит без связи с некрозом, который обычно представляет собой последствия повреждения клеток. Этот тип апоптоза может быть вызван различными сигнальными путями и может быть контролируемым или неконтролируемым.
- Сенсибилизированный апоптоз: происходит при сенсибилизации клеток к апоптозу, когда клетки сверхчувствительны к смертельным сигналам. Этот тип апоптоза может возникнуть в ответ на различные стрессовые условия, такие как радиация или химические воздействия.
- Аутофагический апоптоз: сопровождается одновременно с процессом аутофагии, который представляет собой деградацию и переработку клеточных компонентов. Этот тип апоптоза может быть результатом дисбаланса между процессами аутофагии и выживания клеток.
- Через программированную гибель митохондрий: происходит, когда митохондрии, энергетические органеллы клеток, подвергаются деструкции. Этот тип апоптоза может быть вызван различными факторами, включая изменение электроимпеданса митохондрий или патологическое изменение внутриклеточного потенциала.
Разнообразие типов программированной гибели клеток подчеркивает сложность и диверсификацию этого процесса в организме. Каждый тип апоптоза имеет свои особенности, что позволяет клеткам адаптироваться к различным условиям и обеспечивает баланс между созданием новых клеток и их уничтожением.
Апоптоз и его роль в программированной гибели клеток
Апоптоз является активным процессом, контролируемым внешними и внутренними сигналами. Внешние сигналы могут поступать от окружающей среды или от других клеток, а внутренние сигналы могут возникать внутри самой клетки. Сам клетка также может принять решение о своей судьбе, апоптоз или выживание, исходя из этих сигналов.
Апоптоз является важным процессом во время эмбриогенеза, развития органов и тканей, а также поддержания гомеостаза организма. Он также играет роль в элиминации поврежденных клеток, предотвращая их негативное влияние на окружающие ткани и клетки.
Апоптоз может быть активирован различными факторами, такими как повреждение ДНК, стресс, инфекция или нехватка питательных веществ. Клетки, которые не способны исправить повреждения или пройти через процесс репарации, активируют апоптозный путь, чтобы предотвратить противоречивые эффекты поддержания поврежденных клеток в организме.
Процесс апоптоза включает в себя характеристические изменения в клетке, такие как сжатие и округление клеточного ядра, сворачивание клеточных органелл, образование мембранного пузыря и формирование ореола сигнала, который помогает фагоцитам распознать и удалить мертвые клетки.
Апоптоз также играет важную роль в патологических состояниях, таких как рак. Неконтролируемое размножение клеток может привести к развитию опухоли, и апоптоз может служить как защитный механизм организма для подавления таких клеток и предотвращения их распространения.
Таким образом, апоптоз - важный процесс, который играет роль в программированной гибели клеток и поддержании нормального функционирования организма. Понимание механизмов апоптоза имеет большое значение для развития новых методов лечения различных заболеваний.
Некроз и его влияние на организм в контексте программированной гибели клеток
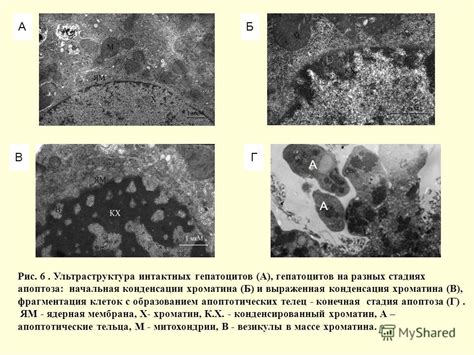
При некрозе происходит разрушение клеток и окружающих их структур, что приводит к выпуску содержимого клеток в окружающую среду. Это может ущербно сказаться на здоровье организма в целом, так как выпущенные вещества могут вызвать воспалительные реакции и повреждения других клеток.
В отличие от программированной гибели клеток, некроз не подчиняется строго определенным механизмам и регуляторам. Обычно он вызывается внешними факторами, такими как травма, инфекция, ишемия или химические воздействия. Некроз может быть также последствием длительного старения клеток или нарушения их функций.
Влияние некроза на организм может быть серьезным. Поступившие из разрушенных клеток медиаторы воспаления могут спровоцировать развитие воспалительных заболеваний и повреждение окружающих здоровых тканей. Кроме того, некроз может привести к утрате функции поврежденного органа или ткани, что может повлечь за собой серьезные последствия для организма в целом.
В современной медицине и науке широко исследуются механизмы некроза и разрабатываются методы его предотвращения и лечения. Такие методы включают в себя использование антиоксидантов, противовоспалительных средств, регуляторов клеточной смерти и технологий, направленных на тканевую регенерацию.
Изучение влияния некроза на организм в контексте программированной гибели клеток позволяет более полно понять процессы, происходящие в организме при гибели клеток, и разработать более эффективные методы предотвращения, диагностики и лечения различных заболеваний.
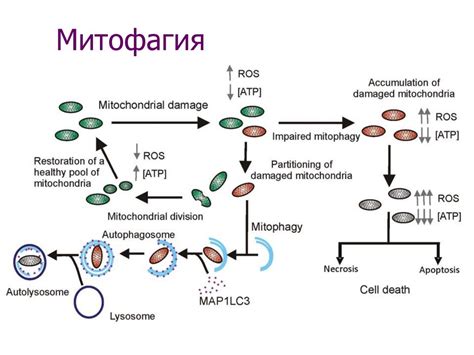
Аутофагия и ее связь с процессом программированной гибели клеток
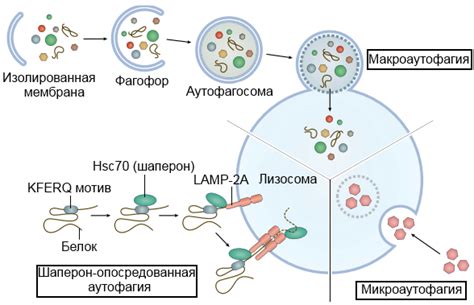
Аутофагия также имеет прямую связь с процессом программированной гибели клеток, известной также как апоптоз. Программированная гибель клеток – это активный механизм, при котором клетки выбирают смерть в ответ на определенные сигналы. Она является важной частью развития и поддержания здоровья организма.
Аутофагия и апоптоз тесно связаны между собой. На самом деле, они являются двумя взаимодополняющими процессами, которые могут влиять друг на друга и работать совместно. Аутофагия может снижать уровень стресса в клетке и предотвращать набор повреждений, которые могут привести к апоптозу. С другой стороны, апоптоз может стимулировать аутофагию, что помогает очистить клетку от поврежденных органелл и белков.
Аутофагия также может сыграть важную роль в регуляции апоптоза. Она может контролировать протеолитический каскад, который приводит к активации апоптотических факторов. Более того, через регуляцию митофагии - селективной автофагии, направленной на разрушение поврежденных митохондрий, аутофагия может контролировать уровень оксидативного стресса и предотвращать активацию апоптоза.
В целом, аутофагия и апоптоз тесно взаимодействуют и влияют друг на друга. Понимание этой связи может помочь в разработке новых методов лечения различных заболеваний, связанных с дисфункцией клеточной смерти и дегенеративными процессами.
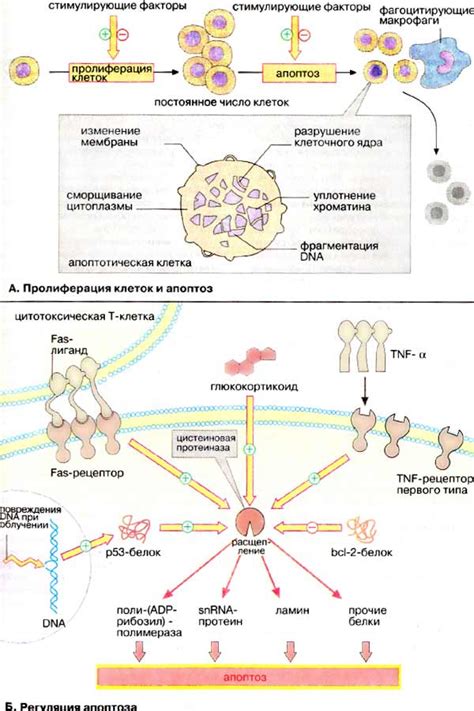
Регуляция программированной гибели клеток: ключевые факторы
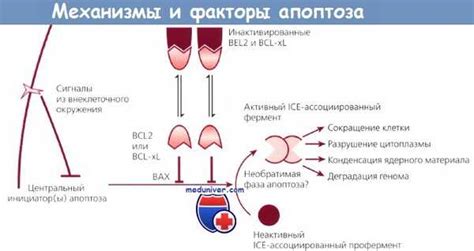
Регуляция апоптоза осуществляется при помощи различных ключевых факторов, которые контролируют и модулируют сигнальные пути, участвующие в этом процессе.
1. Цитокины и ростовые факторы
Многие цитокины и ростовые факторы могут усиливать или подавлять программированную гибель клеток. Например, факторы роста эпителиальных клеток и интерлейкины-1 могут способствовать выживанию клеток, в то время как TNF-α и интерферон-γ могут стимулировать апоптоз.
2. Сигнальные пути
Сигнальные пути играют решающую роль в регуляции апоптоза. Например, семейство белков Bcl-2, включающее Bax и Bak, регулирует проницаемость митохондрий и может предотвращать или инициировать апоптоз. Кроме того, протеинкиназы, такие как PI3K/Akt, могут активировать выживание клеток и ингибировать апоптоз.
3. Внешние и внутренние сигналы
Программированная гибель клеток может быть вызвана различными внешними и внутренними сигналами. Например, повреждение ДНК или недостаток питательных веществ может активировать апоптоз. А действие проточных факторов, таких как окислительный стресс, может способствовать апоптозу путем повреждения молекул ДНК и белков.
Биологические пути и сигнальные молекулы в программированной гибели клеток
Программированная гибель клеток, также известная как апоптоз, это строго регулируемый процесс устранения поврежденных, старых или ненужных клеток организма. Данный процесс играет важную роль в поддержании нормальной функции тканей и органов.
Биологические пути, которые участвуют в апоптозе, включают в себя сложную сеть взаимосвязанных сигналов и регуляторных молекул. Один из ключевых путей программированной гибели клеток называется путем митохондриальной апоптозной дорожки.
В ходе этого пути, поврежденные или стрессированные клетки активируют протеазы, называемые каспазами, которые последовательно вызывают каскад реакций, приводящих к гибели клетки. Одной из ключевых сигнальных молекул в этой дорожке является цитохром с, который выпускается из митохондрий в цитоплазму и активирует каспазы.
Другой важным путем апоптоза является путь рецепторно-связанной апоптозной дорожки. В этом пути, клетки реагируют на внешние смертельные сигналы, например, цитокины, факторы роста или РНК вирусов, которые связываются с определенными рецепторами на поверхности клетки. Это активирует каскад реакций, в результате чего клетка подключает апоптоз.
Помимо этих двух основных путей, существуют и другие пути, которые участвуют в программированной гибели клеток, такие как путь эндоплазматического ретикулума и путь ответа на ДНК повреждения. Каждый из этих путей включает в себя уникальные сигнальные молекулы и механизмы, которые регулируют процесс апоптоза.
Исследование биологических путей и сигнальных молекул в программированной гибели клеток является важной задачей для понимания механизмов апоптоза и его роли в различных физиологических и патологических состояниях организма. Это позволяет разрабатывать новые подходы к лечению различных заболеваний, таких как рак, нейродегенеративные заболевания и воспалительные заболевания.



