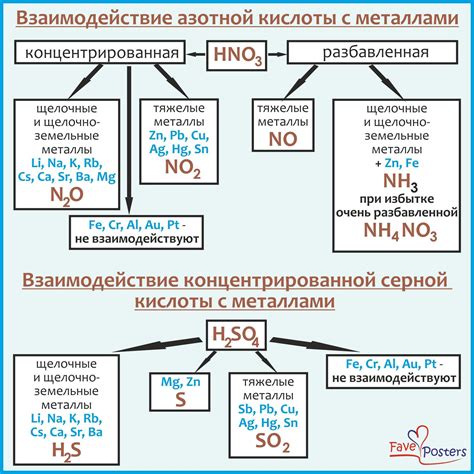
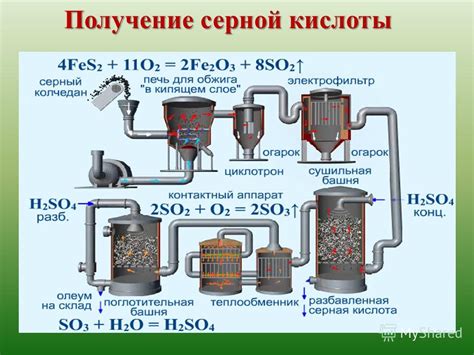
Серная кислота - вещество, широко используемое в промышленности и лаборатории. Ее синтезируют путем окисления сероводорода или серы. В чистом виде она представляет собой безцветную жидкость с острым запахом. Серная кислота имеет сильные кислотные свойства и широко применяется в химической и фармацевтической промышленности.
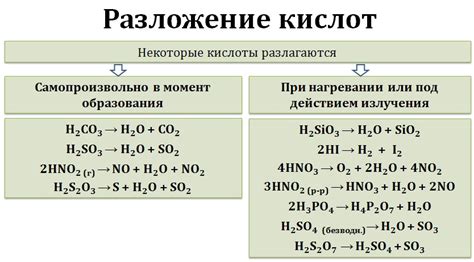
Разложение серной кислоты - это процесс ее превращения в другие вещества под воздействием высокой температуры. При нагревании серной кислоты она начинает диссоциировать на воду и диоксид серы. Реакция разложения серной кислоты происходит поэтапно и сопровождается выделением значительного количества тепла.
Сначала серная кислота превращается в сернистый ангидрид (диоксид серы) и воду по следующей реакции:
H2SO4 → SO2 + H2O
Далее диоксид серы может продолжить разлагаться до монооксида серы и свободного кислорода:
2SO2 → 2SO + O2
Разложение серной кислоты при нагревании играет важную роль в различных процессах, таких как производство серной кислоты, обработка полимеров и многие другие. Понимание и контроль этой реакции имеет большое значение для промышленных и научных целей.
Серная кислота: состав и свойства

Серная кислота является сильным дипротическим органическим кислотным соединением. Она характеризуется следующими свойствами:
| Молярная масса | 98 г/моль |
| Плотность | 1,84 г/см³ |
| Температура кипения | 337 °C |
| Температура плавления | -20 °C |
| Растворимость в воде | полностью растворяется |
| Формула | H2SO4 |
Серная кислота является сильным окислителем и ингибитором. Она обладает высокой степенью коррозии и может вызывать ожоги при контакте с кожей и слизистыми. В промышленности серная кислота широко используется для производства удобрений, взрывчатых веществ и других химических соединений.
Состав серной кислоты
Серная кислота, также известная как сульфатная кислота, имеет химическую формулу H2SO4. Ее молекула состоит из двух атомов водорода, одного атома серы и четырех атомов кислорода. Серный атом находится в центре молекулы, соединяясь с двумя атомами кислорода через двойные связи, и образует два протонных центра, что делает серную кислоту дипротической. Это означает, что серная кислота может отдавать два протона (водородных ионов) в реакциях с щелочами или металлами.
Физические свойства серной кислоты
Другой важной физической характеристикой серной кислоты является ее плотность, которая зависит от концентрации раствора. Концентрированная серная кислота имеет плотность около 1,84 г/см3, что делает ее одним из самых плотных растворов. Более разбавленные растворы имеют меньшую плотность.
Серная кислота также известна своей высокой кислотностью. Она является сильным окислителем и реагирует с многими органическими и неорганическими соединениями. Также серная кислота обладает высокой электропроводностью и ионизируется в водном растворе.
Благодаря этим свойствам, серная кислота широко применяется в промышленности, включая производство удобрений, катализаторов, пластмасс и многих других химических соединений. Она также используется в лабораториях и в бытовых целях, например, для очистки и дезинфекции поверхностей.
| Свойство | Значение |
|---|---|
| Молярная масса | 98,079 г/моль |
| Плотность | 1,84 г/см3 |
| Температура кипения | 337 °C |
| Индекс преломления | 1,41 |
| pKa | -3,0 |
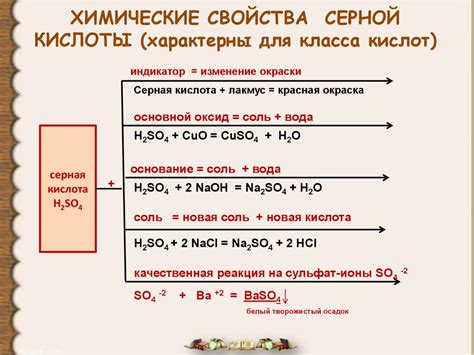
Химические свойства серной кислоты

Серная кислота обладает характеристическими свойствами, которые делают ее полезной в разных областях промышленности и науки. Ниже приведены основные химические свойства этого соединения:
- Кислотные свойства: Серная кислота является сильным кислотным веществом. Она реагирует с основаниями, образуя соль и воду. Также, она способна диссоциировать в водном растворе на ионы водорода и сульфатные ионы.
- Окислительные свойства: Серная кислота – сильный окислитель. Она может окислять многие вещества, включая металлы, неокисленные неметаллы и органические соединения.
- Образование эстеров: Серная кислота способна образовывать эстеры – органические соединения, состоящие из сульфатной группы и остатка кислоты. Эти эстеры обладают характерными запахами и широко используются в парфюмерии и ароматизированной промышленности.
- Дегидратирующие свойства: Серная кислота обладает сильными дегидратирующими свойствами, что означает, что она может отнимать воду из других веществ или соединений. Это свойство делает ее полезной в синтезе органических соединений и ставит ее важную роль в промышленности.
Это лишь несколько основных свойств серной кислоты. Ее реакционная способность и пригодность для различных применений делают ее одним из самых значимых и широко применяемых химических соединений в мире.
Разложение серной кислоты
Процесс разложения серной кислоты начинается при температуре около 300 градусов Цельсия. При этой температуре начинаются реакции, в результате которых образуются два основных продукта - двухокись серы (SO2) и вода (H2O).
| Уравнение реакции: | Название реакции: |
|---|---|
| H2SO4 → H2O + SO2 | Разложение серной кислоты |
В результате разложения серной кислоты образуется газовая фаза в виде двухокиси серы (SO2). Эта реакция идет с выделением большого количества теплоты.
Двухокись серы (SO2) является еще одним продуктом разложения серной кислоты. SO2 - это ядовитый газ с характерным запахом, который может образовывать сернистый ангидрид на поверхности окружающих предметов и вызывать серьезные проблемы дыхательной системы, если вдыхается в больших дозах.
Таким образом, разложение серной кислоты при нагревании является важной и интересной реакцией, процесс которого выполняется при высоких температурах и приводит к образованию двухокиси серы (SO2) и воды (H2O).
Реакция разложения серной кислоты

При нагревании серная кислота проходит процесс разложения на несколько компонентов, включая воду (H2O), сернистый газ (SO2) и кислород (O2). Реакция разложения серной кислоты может быть представлена следующим химическим уравнением:
2H2SO4 → 2H2O + 2SO2 + O2
Таким образом, при нагревании серной кислоты происходит распад ее молекул на компоненты, которые имеют другую химическую структуру и свойства. Водяной пар, сернистый газ и кислород являются продуктами разложения серной кислоты и могут использоваться в различных химических процессах и промышленных приложениях.
Реакция разложения серной кислоты является экзотермической, то есть при ее проведении выделяется тепло. При этом происходит разрушение химических связей в молекуле серной кислоты, что приводит к образованию новых соединений.
Реакция разложения серной кислоты при нагревании является важным процессом в химической промышленности. Полученные при разложении продукты имеют широкий спектр применения, начиная от использования в производстве удобрений и синтезе органических соединений до применения в процессах очистки воды и выработке электроэнергии.
Условия разложения серной кислоты
Разложение серной кислоты может происходить при нагревании под определенными условиями. Этот процесс может быть вызван физическими или химическими факторами. Важно учитывать следующие условия:
- Температура: разложение серной кислоты начинается при нагревании выше 300°C. При этой температуре происходит диссоциация молекул серной кислоты на сероводород и оксид серы.
- Присутствие катализаторов: некоторые вещества, такие как медь или железо, могут ускорить процесс разложения серной кислоты. Они служат катализаторами, повышая скорость реакции.
- Концентрация серной кислоты: концентрированная серная кислота (содержащая 98% или более) более склонна к разложению, особенно при повышенных температурах.
Итак, разложение серной кислоты происходит при нагревании выше 300°C в присутствии катализаторов и зависит от концентрации кислоты. Это является важным фактором при проектировании и безопасном использовании серной кислоты в промышленности.
Применение разложения серной кислоты
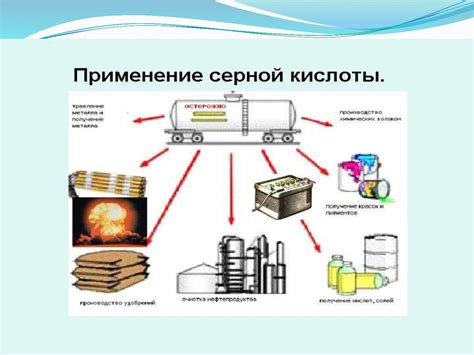
Разложение серной кислоты при нагревании имеет широкое применение в различных областях.
В промышленности разложение серной кислоты используется для получения двуокиси серы и сернистого ангидрида. Двуокись серы применяется в качестве сырья для производства серной кислоты и серной краски. Сернистый ангидрид используется в технологии беления текстильных и целлюлозно-бумажных материалов.
В лаборатории разложение серной кислоты применяется для получения кислорода, который используется в химических анализах и в других химических реакциях. Также разложение серной кислоты может применяться для получения продуктов реакции, таких как сульфаты и сульфиты.
В производстве удобрений разложение серной кислоты используется для получения сульфата аммония, который является одним из основных компонентов азотно-серной смеси. Сульфат аммония применяется для удобрения различных культурных растений и повышения их урожайности.
Таким образом, разложение серной кислоты является важной химической реакцией, которая находит применение в различных областях промышленности и научных исследованиях.



