Сера - очень распространенный элемент, который используется в различных отраслях промышленности. При сжигании серы на воздухе образуется сернистый ангидрид, который взаимодействует с молекулами воды в воздухе, образуя серную кислоту.
Процесс сжигании серы на воздухе начинается с образования двуокиси серы (диоксида серы) - SO2. Данный газ активно окисляется под воздействием воздуха, превращаясь в сернистый ангидрид (триоксид серы) - SO3.
После образования сернистого ангидрида он реагирует с водяными молекулами в воздухе, образуя серную кислоту. Данная реакция происходит с выделением большого количества тепла и созданием характерного зловонного запаха. Серная кислота является сильным кислотным соединением, способным растворять многие металлы и обладающим широким спектром применения в промышленности и химии.
Процесс образования серной кислоты

Уравнение реакции сжигания серы выглядит следующим образом:
- S + O2 → SO2
Полученная вещество – диоксид серы (SO2) – очень важно в дальнейшем процессе образования серной кислоты. Возникающий диоксид серы, растворяясь в воде, образует сульфиты.
Следующий этап процесса – окисление сульфитов до сульфатов. Для этого используется кислород воздуха.
Уравнение реакции окисления сульфитов выглядит следующим образом:
- SO2 + 1/2 O2 + H2O → H2SO4
Полученная вещество – серная кислота (H2SO4) – является конечным продуктом сжигания серы.
Основным применением серной кислоты является производство удобрений, взрывчатого вещества и различных химических препаратов.
Сжигание серы на воздухе

При сжигании серы на воздухе происходит окисление серы, которая входит в состав молекулы серы, до двухвалентного состояния. Реакция сжигания серы записывается следующим образом:
- С + O2 → SO2
Полученная при сжигании серы сернистый газ (SO2) образует серную кислоту (H2SO4) при воздействии воды:
- SO2 + H2O → H2SO3
- H2SO3 + O2 → H2SO4
Образование серной кислоты происходит в несколько этапов. Сначала сернистый газ (SO2) реагирует с водой (H2O), образуя сернистую кислоту (H2SO3). Затем сернистая кислота окисляется до серной кислоты (H2SO4) под действием кислорода (O2) из воздуха.
Серная кислота (H2SO4) – сильная безцветная кислота, являющаяся одной из основных химических продукций в мире. Она широко используется в промышленности для производства удобрений, добывания металлов, производства синтетических материалов и других целей.
Таким образом, сжигание серы на воздухе – это важный и неотъемлемый процесс в химической промышленности, который приводит к образованию серной кислоты – одного из важнейших химических соединений.
Химическая реакция

Сначала требуется начальная активация реакции, которая может произойти при нагревании серы до температуры воспламенения. При этом сера взрывается и образуется взвесья диоксида серы (SO2), который имеет ярко-характерный запах.
Далее, диоксид серы (SO2) реагирует с кислородом воздуха (O2) в присутствии катализатора (например, платины) по следующей реакции:
2SO2 + O2 → 2SO3
И, наконец, полученный диоксид серы (SO3) реагирует с водой (H2O), образуя серную кислоту:
SO3 + H2O → H2SO4
В данной реакции серная кислота образуется в виде густого дыма, а также выделяется много тепла. Серная кислота является сильной кислотой и способна образовывать гидраты, т.е. соединения с водой. В зависимости от концентрации серной кислоты, дым может быть безцветным или иметь характерный серовато-белый цвет.
Химическая реакция сжигания серы на воздухе является важным процессом для промышленного производства серной кислоты, которая широко используется в различных областях, включая химическую промышленность, производство удобрений, нефтепереработку и другие отрасли.
Роль кислорода
При сжигании серы на воздухе кислород выступает в качестве окислителя. Он проникает в реакционную зону и вступает в реакцию с серой, образуя устойчивое соединение серного ангидрида (SO2).
Окисление серы кислородом является экзотермической реакцией, то есть при этом выделяется значительное количество энергии в виде тепла. Образующийся серный ангидрид (SO2) обычно выглядит как белый дым и имеет резкий запах.
Далее, полученный серный ангидрид SO2 реагирует с влагой в воздухе, окисляясь до серной кислоты (H2SO4). Данная реакция происходит по следующему уравнению:
SO2 + H2O + O2 → H2SO4
Таким образом, сжигание серы на воздухе с участием кислорода приводит к образованию серной кислоты (H2SO4), которая является сильным окислителем и обладает рядом полезных свойств. Серная кислота широко используется в различных отраслях промышленности и научных исследованиях.
Образование диоксида серы
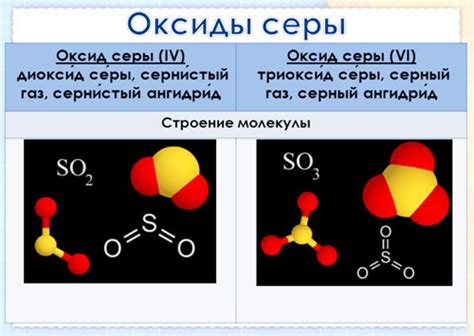
При горении серы на воздухе происходит окисление серы, в результате чего образуются молекулы диоксида серы. Реакция, протекающая в этом процессе, можно представить следующим образом:
2S + O2 -> 2SO2
Таким образом, каждая молекула серы реагирует с молекулой кислорода из воздуха, образуя две молекулы диоксида серы.
Диоксид серы является ядовитым газом, который оказывает вредное воздействие на окружающую среду и здоровье людей. Он способен вызывать ряд заболеваний, таких как бронхит и астма. Кроме того, диоксид серы является одним из основных источников кислотных дождей, которые наносят серьезный ущерб растительности и экосистемам.
Для снижения выбросов диоксида серы в атмосферу, применяются различные способы очистки газовых выбросов при производстве и сжигании серы. Одним из таких способов является использование специальных фильтров и оборудования, которые позволяют поглощать и улавливать диоксид серы до его выброса в атмосферу.
Превращение диоксида серы в серную кислоту

Сжигание серы на воздухе приводит к образованию диоксида серы (SO2), который затем может быть превращен в серную кислоту (H2SO4).
Процесс превращения диоксида серы в серную кислоту является химической реакцией, которая происходит в несколько этапов.
Первоначально диоксид серы (SO2) вступает во взаимодействие с кислородом (O2) и образует сернистый ангидрид (SO3):
| Реагенты | Реакция | Продукты |
|---|---|---|
| SO2 + O2 | → | SO3 |
Затем сернистый ангидрид (SO3) вступает во взаимодействие с водой (H2O) и превращается в серную кислоту (H2SO4):
| Реагенты | Реакция | Продукты |
|---|---|---|
| SO3 + H2O | → | H2SO4 |
Процесс превращения диоксида серы в серную кислоту является важным шагом в производстве серной кислоты, которая широко используется в различных отраслях промышленности и научных исследованиях. Этот процесс позволяет получать серную кислоту из ресурсов серы и воздуха, что является экономически эффективным и экологически безопасным способом производства.



