Полярность и неполярность - одни из важнейших свойств веществ, которые играют решающую роль в химических реакциях и физических свойствах веществ. Эти понятия являются основой для понимания сил взаимодействия между атомами и молекулами. Полярность и неполярность определяются разностью электроотрицательностей атомов и степенью симметричности молекулы.
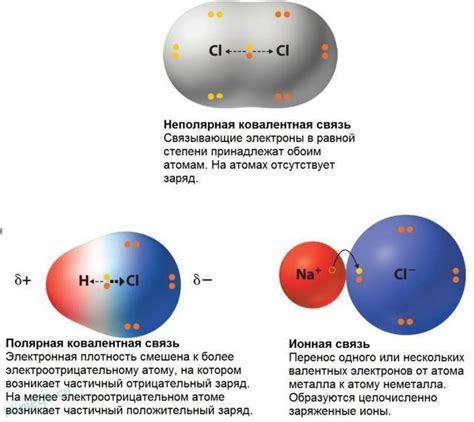
Полярные соединения характеризуются тем, что у них имеется разделение зарядов внутри молекулы. Это происходит из-за асимметричной структуры, когда различные атомы обладают разной электроотрицательностью. Наиболее известным примером полярного соединения является вода (H2O), где кислород обладает большей электроотрицательностью, чем водород, что приводит к разделению зарядов и образованию полярной связи.
Неполярные соединения, наоборот, не имеют разделения зарядов и характеризуются равной распределенностью электронной плотности. Это происходит из-за симметричной структуры молекулы или наличия только одного вида атомов. Примерами неполярных соединений являются молекулы кислорода (O2), азота (N2) и метана (CH4), где образуются только неполярные связи.
Полярность и неполярность веществ существенно влияют на их физические свойства. Полярные соединения имеют более высокую температуру кипения и плавления, а также обладают большей растворимостью в полярных растворителях, таких как вода. Неполярные соединения, напротив, имеют более низкие температуры кипения и плавления, а также обладают большей растворимостью в неполярных растворителях, таких как бензин или гексан.
Полярность и неполярность в химии
В химии понятия полярности и неполярности играют важную роль при изучении свойств химических соединений и взаимодействия молекул. Они отражают различия в распределении электронной плотности в молекулах и влияют на их химическую активность.
Полярность молекулы определяется разностью в электронной плотности между атомами. Если электронная плотность смещена к одному атому в молекуле, то такая молекула называется полярной. Это обусловлено различием в электроотрицательности атомов, которое вызывает смещение электрона к атому с более высокой электроотрицательностью. Полярные молекулы характеризуются дипольным моментом, который может влиять на их физические и химические свойства.
Неполярные молекулы имеют более равномерное распределение электронной плотности между атомами и не обладают дипольным моментом. В таких молекулах различие в электроотрицательности атомов минимально или отсутствует. Примером неполярной молекулы может служить молекула кислорода (O2), в которой два атома кислорода имеют одинаковую электроотрицательность, и электронная плотность равномерно распределена между ними.
Знание о полярности и неполярности молекул позволяет лучше понять их растворимость в разных растворителях и взаимодействие с другими химическими веществами. Также это помогает в объяснении свойств молекулярных веществ, например, поверхностного натяжения и температуры кипения.
Важно отметить, что полярность или неполярность молекулы не зависит от ее размера или формы. Это свойство зависит только от разности электроотрицательности и геометрии молекулы.
В химии даже кажущаяся незначительная разность в полярности молекул может иметь значительное влияние на их взаимодействие и свойства, поэтому эти понятия являются важными в химическом анализе и синтезе веществ.
Основные понятия

Водород и кислород являются примером полярной молекулы. Водород имеет электроотрицательность около 2.1, тогда как кислород - около 3.5. В результате, электроны в водной молекуле смещены ближе к кислороду, что делает молекулу полярной. Полярность воды позволяет ей образовывать водородные связи и обладать свойствами, такими как поверхностное натяжение и растворимость различных веществ.
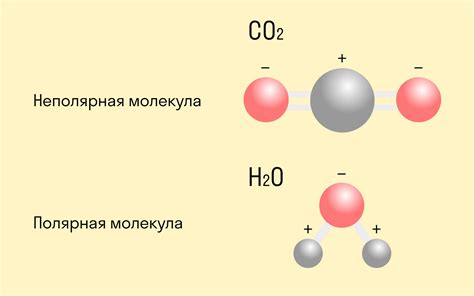
С другой стороны, неполярные молекулы обладают равномерным распределением электронной плотности, так как атомы в них имеют одинаковую электроотрицательность. Примером неполярной молекулы является молекула углекислого газа (CO2). В этой молекуле электронная плотность равномерно распределена между атомами углерода и кислорода, что делает ее неполярной.
Полярность и неполярность играют важную роль во многих химических процессах, так как взаимодействие молекул и ионов зависит от их электроотрицательности и полярности. Понимание основных понятий полярности и неполярности позволяет лучше понять молекулярное строение и свойства вещества.
Молекулы с полярной связью
В химии существует большое количество молекул, которые имеют полярную связь. Это означает, что электронная плотность между атомами в молекуле не равномерно распределена, а смещена в сторону одного из атомов. Такое смещение электронной плотности создает разность частичных зарядов между атомами, что делает молекулу полярной.
Примером молекулы с полярной связью может служить молекула воды (H2O). Водный молекул решеточной структуры, атомы кислорода (O) занимают центральное положение, и к ним ковалентно связаны два атома водорода (H). При этом, электронная плотность в молекуле смещена в сторону атома кислорода, так что он приобретает слегка отрицательный частичный заряд, а атомы водорода приобретают слегка положительный заряд. Таким образом, молекула воды является полярной.
Еще одним примером молекулы с полярной связью может служить молекула аммиака (NH3). В молекуле аммиака атомы азота (N) и водорода (H) связаны ковалентной связью. Атом азота имеет большую электроотрицательность, чем атомы водорода, поэтому электронная плотность смещена ближе к азоту. Это приводит к появлению положительного заряда на атомах водорода, а отрицательного заряда на азоте, делая молекулу аммиака полярной.
Молекулы с полярной связью обладают рядом химических и физических свойств, связанных с их полярностью. Эти свойства включают повышенную растворимость в полярных растворителях, возможность образования водородных связей и способность к образованию диполь-дипольных взаимодействий.
Молекулы с неполярной связью
Примером молекулы с неполярной связью является молекула метана (CH4). Метан состоит из одного атома углерода и четырех атомов водорода. В молекуле метана электроотрицательность углерода и водорода практически одинакова, поэтому электронная плотность равномерно распределена между атомами, и молекула не обладает дипольным моментом.
Другим примером молекулы с неполярной связью является молекула азота (N2). В молекуле азота два атома азота связаны тройной связью. Электроотрицательность азота также одинакова, поэтому электронная плотность равномерно распределена между атомами, и молекула не обладает дипольным моментом.
Молекулы с неполярной связью обычно не растворяются в полярных растворителях, таких как вода. При этом они лучше растворяются в неполярных растворителях, таких как бензин или гексан.
Влияние полярности на свойства веществ

Полярные вещества, такие как вода, обладают постоянной дипольной моментом, благодаря которому они образуют водородные связи и проявляют характерные свойства, такие как высокая температура кипения и плотность. Их молекулы притягиваются друг к другу с помощью сил взаимодействия, что делает их устойчивыми в жидком и твердом состоянии.
С другой стороны, неполярные вещества, такие как масло или бензин, не обладают постоянным дипольным моментом и не формируют силы взаимодействия между своими молекулами. Их частицы слабо связаны друг с другом и имеют более низкую температуру кипения и плотность по сравнению с полярными веществами.
Полярность также оказывает влияние на растворимость веществ. Полярные вещества обычно растворяются в полярных растворителях, так как полярные молекулы способны взаимодействовать друг с другом. Неполярные вещества, напротив, растворяются в неполярных растворителях.
Эти свойства полярных и неполярных веществ существенно влияют на их применение в различных областях науки и технологии, включая химическую синтез, фармацевтику, пищевую промышленность и электронику. Понимание полярности и ее влияние на свойства веществ является фундаментальным вопросом не только для химиков, но и для всех, кто интересуется химией и ее применением в повседневной жизни.
Примеры из химии

В химии существует множество примеров, которые помогают проиллюстрировать понятия полярности и неполярности веществ. Рассмотрим несколько из них:
1. Молекула воды: Вода является полярной молекулой благодаря наличию полярных ковалентных связей между атомами кислорода и водорода. Это приводит к образованию диполя воды, что позволяет ей образовывать водородные связи и обладать уникальными физическими свойствами.
2. Молекула кислорода: Кислород – это неполярная молекула, так как все его химические связи между атомами кислорода являются неполярными. Это означает, что взаимодействие с другими веществами осуществляется иными механизмами.
3. Молекула углекислого газа: Углекислый газ – неполярная молекула, хотя в ней содержатся полярные связи между атомом углерода и атомами кислорода. Однако, симметричная форма молекулы и отсутствие разности в электроотрицательности атомов гарантируют отсутствие дипольного момента и, следовательно, неполярность.
4. Молекула аммиака: Аммиак – это полярная молекула, так как имеет полярные связи между атомами азота и водорода, а также пирамидальную структуру. Это приводит к возникновению дипольного момента, делая его полярным соединением.
Это лишь несколько примеров из множества веществ, представленных в химии, которые помогают наглядно проиллюстрировать понятия полярности и неполярности.



