Положительная и отрицательная степень окисления - понятия, которые используются в химии для описания электрического заряда атомов или групп атомов в химических соединениях. Они помогают определить, сколько электронов было передано или получено элементом, и тем самым позволяют нам понять его активность в химических реакциях.
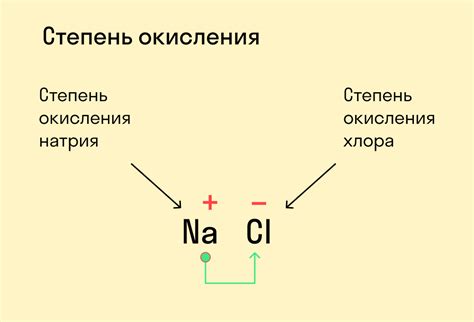
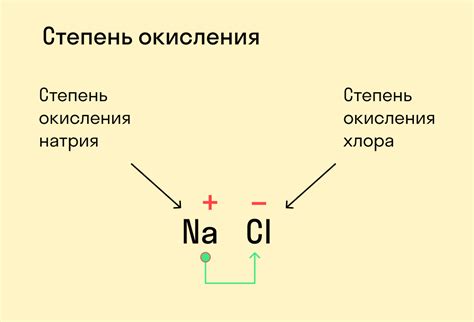
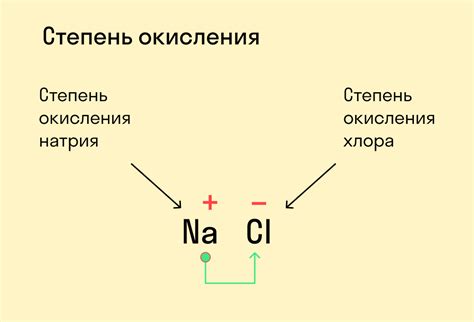
Степень окисления измеряется в единицах заряда - элементарных зарядах электрона. Если атом отдал электроны и стал положительно заряженным, его степень окисления положительная. Например, в соединении NaCl натрий имеет степень окисления +1, так как он отдал один электрон хлору, который при этом приобрел степень окисления -1.
С другой стороны, если атом или группа атомов получили электроны и стали отрицательно заряженными, их степень окисления отрицательная. Например, в воде (H2O) кислород имеет степень окисления -2, так как он получил два электрона от двух водородных атомов, у которых степень окисления +1 каждый.
Значение понятия "степень окисления"
Степень окисления обозначается числом, которое может быть положительным, отрицательным или равным нулю. Положительная степень окисления указывает на окислительные свойства вещества, то есть его способность получать электроны от других веществ. Отрицательная степень окисления, наоборот, указывает на восстановительные свойства вещества, то есть его способность отдавать электроны.
Знание степеней окисления атомов в химических соединениях позволяет определить, какие вещества будут взаимодействовать между собой и какие реакции будут протекать. Она также необходима для составления химических формул и уравнений реакций.
Основные принципы определения степени окисления
Степень окисления (степень восстановления) атома в химическом соединении выражает формальное число электронов, участвующих в образовании связей. Она позволяет определить, насколько атом в конкретном соединении потерял или приобрел электроны.
Определение степени окисления осуществляется с помощью следующих основных принципов:
- Атомы элементарных веществ всегда имеют степень окисления, равную нулю. Например, в молекуле кислорода (O2) каждый атом кислорода имеет степень окисления, равную нулю.
- Степень окисления простого иона равна заряду иона. Например, в ионе Fe3+ (железа(III) ион) степень окисления железа равна +3, так как ион имеет заряд +3.
- Степень окисления алкалийных металлов (например, Li, Na, K) и щелочноземельных металлов (например, Mg, Ca) всегда равна +1 и +2 соответственно.
- Степень окисления водорода в соединениях, где он является более электроотрицательным элементом, равна +1. Например, в молекуле H2O (воды) степень окисления водорода равна +1.
- Степень окисления кислорода в соединениях, где он является менее электроотрицательным элементом, равна -2. Например, в молекуле CO2 (углекислого газа) степень окисления кислорода равна -2.
- Алгебраическая сумма степеней окисления всех атомов в химическом соединении равна заряду этого соединения. Например, в молекуле NaCl (хлорида натрия) степень окисления натрия равна +1, а степень окисления хлора равна -1, что дает алгебраическую сумму +1 + (-1) = 0, что соответствует нейтральному заряду соединения.
Знание основных принципов определения степени окисления позволяет проводить расчеты и упростить понимание химических реакций и свойств веществ.
Положительная степень окисления и ее значение
Степень окисления представляет собой численное значение, которое указывает на количество электронов, переданных атомом в процессе окисления или восстановления. Положительная степень окисления означает, что атом отдал электроны и при этом образовал положительный заряд.
Положительная степень окисления имеет важное значение при определении окислительных и восстановительных свойств вещества. Вещество с положительной степенью окисления может обладать окислительными свойствами и способностью приобретать электроны от других веществ. Такие вещества могут взаимодействовать с веществами, обладающими отрицательной степенью окисления, и вызывать окислительные реакции.
Положительная степень окисления также может использоваться для определения структуры химических соединений. При анализе соединений можно определить, какие элементы имеют положительную степень окисления и как они связаны друг с другом. Это позволяет лучше понять химические свойства соединений и их возможные реакции.
Обращая внимание на положительную степень окисления, химики могут предсказывать поведение вещества и его реакции с другими веществами. Это помогает понять и объяснить различные химические явления и процессы.
Отрицательная степень окисления и ее значение
Отрицательная степень окисления имеет большое значение при определении химических свойств элемента и его взаимодействия с другими веществами. Чем ниже значение степени окисления, тем более электронодонорным элемент является.
Отрицательная степень окисления связана с химической активностью элемента. Чем выше отрицательное значение степени окисления, тем более активным является элемент. Это связано с более легким освобождением электронов и возможностью вступления в реакции окисления с другими веществами.
Отрицательная степень окисления является важной характеристикой для понимания реакционной способности вещества, его способности передавать электроны и взаимодействовать с окружающими атомами или ионами.
Правила определения степени окисления элементов

Следующие правила помогают определить степень окисления элементов:
| Элемент | Правило определения степени окисления |
|---|---|
| Все несвязанные элементы и элементы в составе соединений в нормальном состоянии | Степень окисления равна нулю. |
| Кислород (O) | Степень окисления равна -2, за исключением пероксидов, где степень окисления равна -1. |
| Водород (H) | Степень окисления равна +1, за исключением гидридов металлов, где степень окисления равна -1. |
| Алкалий и алкалиноземельные металлы (группа I и II в периодической системе) | Степень окисления равна +1 и +2 соответственно. |
| Фтор (F) | Степень окисления всегда равна -1. |
| Вещества в остальных случаях | Степень окисления определяется так, чтобы сумма степеней окисления всех атомов в молекуле или ионе была равна заряду молекулы или иона. |
Правильное определение степени окисления элементов является важным шагом для понимания и предсказания химических реакций и свойств веществ. Соблюдение данных правил поможет упростить и систематизировать этот процесс.
Примеры определения степени окисления

1. Водород в гидроксидах: степень окисления водорода в гидроксидах всегда +1. Например, в воде (H2O) степень окисления водорода равна +1.
2. Кислород в пероксидах: степень окисления кислорода в пероксидах всегда -1. Например, в перекиси водорода (H2O2) степень окисления кислорода равна -1.
3. Алканы: степень окисления углерода в алканах всегда равна 0, так как углерод образует только одинарные связи с другими атомами. Например, в метане (CH4) степень окисления углерода равна 0.
4. Алкены и алкины: степень окисления углерода в алкенах и алкинах может быть различной, так как углерод может образовывать двойные или тройные связи с другими атомами. Например, в этилене (C2H4) степень окисления углерода равна -2, так как углерод образует две двойные связи.
| Соединение | Степень окисления |
|---|---|
| Вода (H2O) | +1 / -2 |
| Перекись водорода (H2O2) | -1 / -2 |
| Метан (CH4) | 0 |
| Этилен (C2H4) | -2 |
В этих примерах приведены лишь некоторые соединения и их степени окисления. Определение степени окисления может быть сложнее в более сложных молекулах, где атомы могут иметь разные степени окисления в зависимости от их окружения.
Значение степени окисления в химических реакциях

Значение степени окисления играет важную роль в определении характера реакции: окислитель или восстановитель. Атомы с положительной степенью окисления считаются окислителями, так как они имеют склонность отбирать электроны у других атомов. Атомы с отрицательной степенью окисления считаются восстановителями, так как они имеют способность отдавать электроны.
Значение степени окисления также позволяет определить количество переданных электронов в химической реакции. Если атом увеличивает свою положительную степень окисления, он отдаёт электрон(ы). Если атом уменьшает свою положительную степень окисления, он принимает электрон(ы).
Степень окисления является важным инструментом для балансировки химических уравнений и определения коэффициентов реакций. Зная начальные и конечные значения степеней окисления, можно определить, сколько электронов было передано в ходе реакции, и соответствующим образом сбалансировать уравнение.
Важно отметить, что значение степени окисления может изменяться в зависимости от условий, в которых происходит реакция. Поэтому оно является важным параметром для изучения и анализа химических процессов.
Суммируя вышесказанное, значение степени окисления играет важную роль в понимании химических реакций, предлагая информацию о изменении электроотрицательности и количестве переданных электронов. Она помогает балансировать уравнения реакций и определить роль атомов в окислительно-восстановительных процессах.
Важность понимания степени окисления

Основная цель определения степени окисления состоит в выявлении окислителя и восстановителя в химической реакции. Это важно, так как позволяет установить, какие вещества проявляют активность и непосредственное участие в реакции. Знание степени окисления также способствует более глубокому пониманию химических процессов, что является основой для решения различных задач и найти применение во многих сферах, включая медицину и экологию.
Без понимания степени окисления становится трудно определить направление реакции и предсказать ее результаты. Например, знание степени окисления позволяет определить возможность возникновения коррозии или оценить токсичность химического вещества. Оно также помогает в понимании работы электрохимических элементов, таких как батареи и аккумуляторы.
Кроме того, знание степени окисления является необходимым условием для понимания и разработки синтеза химических соединений, а также развития новых материалов и технологий. Благодаря пониманию степени окисления ученые могут создавать инновационные материалы с новыми свойствами и улучшать существующие технологии.



