Электролиз - это процесс, в ходе которого под действием постоянного электрического тока происходит разложение вещества на ионы. Одним из основных компонентов электролиза являются растворы и расплавы, которые используются в качестве электролитов.
Раствор - это гомогенная система, состоящая из растворителя (обычно вода) и растворенного вещества (электролита). Единицей растворенного вещества являются молекулы или ионы, которые способны проводить электрический ток при наличии заряда. В ходе электролиза раствор разлагается на ионы: положительно заряженные катионы перемещаются к отрицательно заряженному электроду (аноду), а отрицательно заряженные анионы перемещаются к положительно заряженному электроду (катоду).
Расплав, в отличие от раствора, представляет собой плавящийся материал, обладающий электропроводностью. Электроды, погруженные в расплавленное вещество, служат для ввода электрического тока. При прохождении тока через расплав происходит его разложение на ионы, которые перемещаются к электродам в соответствии с их зарядом. Расплавы обычно используются для электролиза металлов или неметаллов в промышленных процессах, таких как производство алюминия или натрия.
В чем разница между раствором и расплавом в электролизе
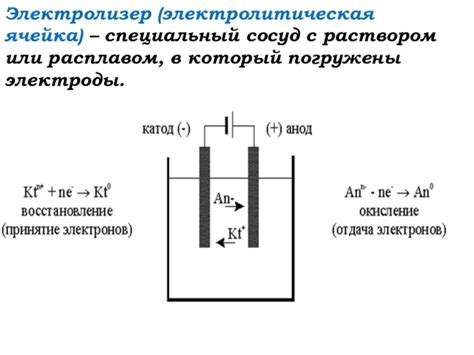
Основным компонентом, используемым в электролизе, является электролит – вещество, которое может проводить электрический ток. В зависимости от состояния электролита различают два основных вида – раствор и расплав.
Раствор – это смесь, состоящая из растворителя и растворенного вещества. В растворе молекулы растворенного вещества диссоциируют и образуют ионы, которые могут проводить электрический ток. Примерами растворов могут служить растворы солей, кислот и щелочей.
Расплав – это твердое вещество, при повышенной температуре переходящее в жидкое состояние. В расплаве атомы и молекулы вещества разделяются на ионы, способные проводить ток. Примерами расплавов могут служить расплавленные металлы или соли.
Таким образом, основное отличие между раствором и расплавом в электролизе заключается в состоянии электролита. В растворе молекулы растворенного вещества находятся в жидком состоянии, а в расплаве – в состоянии твердого вещества, превращающегося в жидкое при повышенной температуре.
| Раствор | Расплав |
|---|---|
| Состоит из растворителя и растворенного вещества | Является твердым веществом при низкой температуре и переходит в жидкое состояние при повышенной температуре |
| Молекулы растворенного вещества диссоциируют и образуют ионы | Атомы и молекулы разделяются на ионы |
| Примеры: растворы солей, кислот и щелочей | Примеры: расплавленные металлы, соли |
Роль растворов и расплавов в электролизе
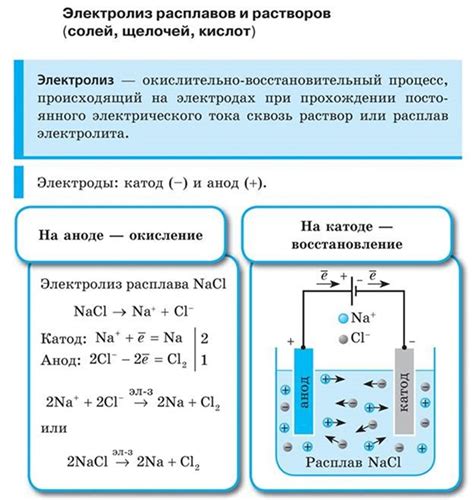
Расплавы обычно состоят из металлов или их соединений, таких как соли. Опыт показывает, что расплавы являются хорошими электролитами, так как ионные связи в их структуре оказываются достаточно слабыми для проведения электрического тока. Это позволяет использовать расплавы в промышленных процессах, таких как производство алюминия методом электролиза.
Растворы же обычно состоят из солей или других химических соединений, растворенных в воде или других растворителях. Вода является хорошей электролитической средой, так как она способна проводить электрический ток благодаря наличию ионов гидроксона и гидроксильных групп в молекуле. Растворы используются в различных электрохимических процессах, например, в производстве хлора и натрия.
В обоих случаях - как при использовании расплавов, так и растворов - электрический ток приводит к процессам окисления и восстановления ионов веществ, находящихся в данной системе. Таким образом, растворы и расплавы играют важную роль в электролизе, обеспечивая проведение электрического тока и возможность производства различных продуктов и веществ.
Состав и структура растворов и расплавов
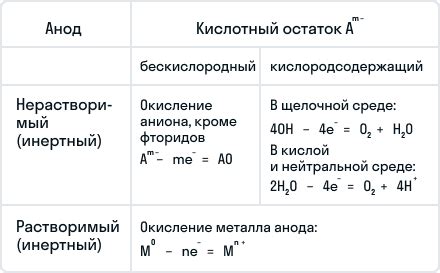
Структура растворов и расплавов также различается. В растворах молекулы растворенных веществ находятся взаимодействие с молекулами растворителя, образуя атомы и ионы. Эти ионы могут быть положительными (катионами) или отрицательными (анионами), в зависимости от заряда их ядра и внешних электронных оболочек.
Расплавы, с другой стороны, образуются при нагревании твердого вещества до температуры плавления, вызывая разрушение связей между атомами или молекулами. В расплавах вещество существует в форме ионов или атомов, свободных от оболочек.
Для более наглядного представления о различиях между растворами и расплавами, представленная таблица дает обзор основных характеристик.
| Характеристика | Растворы | Расплавы |
|---|---|---|
| Состав | Растворитель + растворенные вещества | Одно вещество |
| Структура | Атомы или ионы растворенных веществ взаимодействуют с растворителем | Атомы или ионы без связей или оболочек |
| Температура | Обычная комнатная температура | Высокая температура плавления |
Изучение состава и структуры растворов и расплавов играет важную роль в понимании процессов электролиза и их применения в различных отраслях промышленности и научных исследований.
Проводимость растворов и расплавов

Растворы и расплавы различаются по своей проводимости. Эта разница обусловлена наличием или отсутствием свободных движущихся зарядов, которые могут переносить ток.
В растворе свободными движущимися зарядами могут быть ионы – положительно или отрицательно заряженные частицы. Эти ионы появляются в результате растворения вещества в воде или другом растворителе.
Для проведения электролиза с использованием раствора необходимо, чтобы в растворе были наличие ионы, которые может двигаться под действием электрического поля. Такие растворы называются электролитическими.
Расплавы, в отличие от растворов, могут быть проводниками электрического тока без наличия свободных движущихся ионов. Это обусловлено тем, что в присутствии высокой температуры атомы вещества могут приобрести достаточно энергии для превращения в ионы. Такие расплавы получили название ионических. Примером ионического расплава является расплавенная соль.
Таким образом, проводимость растворов и расплавов в электролизе определяется наличием свободных движущихся зарядов (ионов). В растворах эти заряды существуют благодаря растворению веществ, а в расплавах – благодаря высокой температуре.
Использование растворов и расплавов в электролизе

Растворы используются в электролизе для разделения соединений, которые растворимы в воде или других растворителях. В таких растворах присутствуют положительно и отрицательно заряженные ионы, которые могут перемещаться под действием электрического поля. Положительно заряженные ионы движутся к отрицательному электроду (катоду), а отрицательно заряженные ионы движутся к положительному электроду (аноду).
Расплавы используются в электролизе для разделения соединений, которые имеют высокую температуру плавления, и не растворимы в воде или других растворителях. В расплавах вещества находятся в жидком или кристаллическом состоянии, что позволяет ионам свободно перемещаться и проводить электрический ток. Как и в растворах, при электролизе в расплаве положительно заряженные ионы движутся к отрицательному электроду, а отрицательно заряженные ионы движутся к положительному электроду.
Использование растворов и расплавов в электролизе позволяет производить различные химические реакции, такие как осаждение металлов на электродах или разложение соединений на ионы. Это широко применяется в промышленности для производства различных веществ, а также в лабораторных условиях для исследования химических свойств веществ и проведения химических реакций.
Особенности реакций в растворах и расплавах
Реакции в растворах и расплавах имеют свои особенности, которые определяются физическим состоянием вещества и наличием растворителя или плавящей среды.
Одной из главных различий между растворами и расплавами является наличие диссоциации. В растворах диссоциация происходит за счет взаимодействия растворимого вещества с растворителем, при этом образуются ионы, которые могут участвовать в химических реакциях. В расплавах диссоциация происходит без участия растворителя, а именно благодаря повышенной температуре.
Кроме того, в растворах может протекать реакция обмена ионами – ионное обменное взаимодействие между двумя растворенными солями. При этом происходит образование новых соединений с обратным ионным составом.
В расплавах могут протекать окислительно-восстановительные реакции. Примером такой реакции может служить электролиз, при котором происходит разложение вещества под воздействием электрического тока. В результате этого процесса на электродах образуются новые вещества.
Таким образом, реакции в растворах и расплавах имеют свои особенности, которые определяются физическим состоянием вещества и наличием растворителя или плавящей среды, а также возможностью диссоциации и образования новых соединений.



