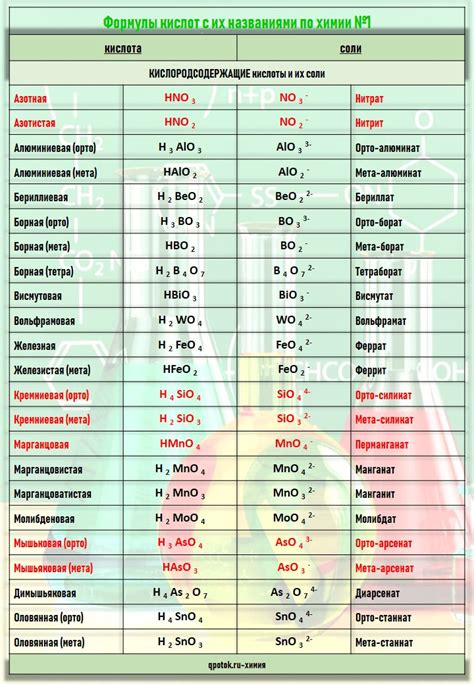
Кислоты - один из основных классов химических соединений, которые взаимодействуют с водой, образуя ион водорода H+ и отрицательный ион, называемый анионом. Классификация кислот основана на их свойствах и характеристиках, а также на параметрах, которые используются для определения их кислотности.
Одним из основных параметров, по которому происходит классификация кислот, является степень диссоциации. Степень диссоциации характеризует способность кислоты распадаться на ионы в водном растворе. Кислоты, которые полностью диссоциируются, называются сильными кислотами, в то время как кислоты, которые слабо диссоциируются, называются слабыми.
Другим важным параметром, используемым для классификации кислот, является константа диссоциации. Константа диссоциации определяет равновесную концентрацию ионов H+ и анионов в растворе кислоты. Большая константа диссоциации указывает на высокую кислотность, в то время как маленькая константа диссоциации указывает на низкую кислотность.
И еще одним важным параметром для определения кислотности является pH. pH - это мера кислотности или щелочности раствора, которая определяется концентрацией ионов водорода H+. Растворы с pH ниже 7 считаются кислыми, растворы с pH выше 7 считаются щелочными, а растворы с pH равным 7 считаются нейтральными.
Таким образом, классификация кислот основана на нескольких основных параметрах, таких как степень диссоциации, константа диссоциации и pH. Эти параметры позволяют определить кислотность каждой отдельной кислоты и классифицировать их в соответствии с их свойствами и характеристиками.
Что такое кислота и почему она важна?

Кислоты являются важным элементом во многих химических и биологических процессах. Они играют роль в органическом синтезе, расщеплении органических веществ, а также в различных метаболических процессах в организмах. Одним из наиболее известных примеров кислоты является соляная кислота, которая имеет широкое применение в промышленности и лабораторных исследованиях.
Кислотность или щелочность раствора имеет важное значение в различных областях, таких как химическая промышленность, медицина, пищевая промышленность и окружающая среда. Уровень кислотности или щелочности представлен pH-шкалой, которая измеряет концентрацию ионов водорода в растворе. Значение pH ниже 7 указывает на кислотность, а значение выше 7 – на щелочность. Знание уровня кислотности позволяет контролировать и регулировать процессы в различных областях деятельности.
| Параметр | Описание |
|---|---|
| Степень диссоциации | Способность кислоты разделиться на положительные и отрицательные ионы в растворе. |
| Сила | Выражается через константу диссоциации и указывает на способность кислоты отдавать протоны в растворе. |
| pH | Мера уровня кислотности или щелочности раствора. |
Определение кислоты и ее роль в общей химии
Определение кислоты основано на ее свойствах и химическом поведении. Главное свойство кислот - это их способность отдавать протоны (водородные ионы) при реакции с другими веществами, такими как основания или металлы. Этот процесс известен как протолиз (или диссоциация) кислоты и является основой для многих химических реакций.
В химии кислотность обычно определяется по их pH-значению, которое указывает на концентрацию водородных ионов в растворе. Кислотность может варьироваться от очень кислой (низкий pH) до слабой кислотности (близкий к нейтральному pH).
Кислоты имеют широкий спектр применений в общей химии. Они могут использоваться в качестве катализаторов, реагентов для различных синтезов и экстрагентов для извлечения металлов. Кроме того, кислоты играют важную роль в медицине и пищевой промышленности, а также используются в процессах очистки воды и производства удобрений.
| Пример | Название кислоты | Основные характеристики |
|---|---|---|
| Соляная кислота | HCl | Сильная кислота, агрессивная к электронике |
| Уксусная кислота | CH3COOH | Слабая кислота, широко используется в пищевой промышленности |
| Серная кислота | H2SO4 | Сильная кислота, широко применяется в производстве удобрений |
Таким образом, кислоты являются важными веществами в химии, которые имеют различные свойства и применения. Изучение кислот позволяет понять их роль и влияние в различных химических процессах, а также предоставляет основу для разработки новых материалов и технологий.
Основные параметры определения кислотности

| Параметр | Описание |
|---|---|
| Концентрация | Определяется количеством кислотных ионов в растворе. Чем больше концентрация кислотных ионов, тем выше кислотность вещества. |
| pH-значение | Мера активности водородных ионов в растворе. Кислотные растворы имеют низкое pH-значение (менее 7), а щелочные растворы - высокое (более 7). |
| Кислотные радикалы | Кислотность может быть определена наличием кислотных радикалов в молекуле вещества. Чем больше таких радикалов, тем выше кислотность. |
| Электроотрицательность | Измеряет способность атома или группы атомов притягивать электроны. Высокая электроотрицательность может указывать на более кислотные вещества. |
| Ионизационная константа | Характеризует степень, с которой кислота диссоциирует в растворе и образует ионы. Большая ионизационная константа указывает на высокую кислотность. |
Эти параметры позволяют оценить степень кислотности вещества и классифицировать его соответствующим образом. При анализе и использовании кислотных веществ важно учитывать все эти параметры для правильного понимания их свойств и реакционной способности.
Концентрация кислоты и pH-уровень

pH-уровень является другим важным показателем для определения кислотности. Он позволяет оценить кислотность или щелочность раствора и указывает на концентрацию ионов водорода (H+) в растворе. pH-уровень может принимать значения от 0 до 14, где 0 - наиболее кислотное значение, а 14 - наиболее щелочное значение.
Чем ниже pH-уровень, тем сильнее кислотность раствора. Например, если pH-уровень равен 1, это означает, что раствор является крайне кислым. Если же pH-уровень равен 7, то раствор считается нейтральным. Щелочные растворы имеют значения pH выше 7.
параметры концентрации кислоты и pH-уровня позволяют классифицировать кислоты и определить их силу и характер взаимодействия с другими веществами.
Титриметрические методы определения кислотности

Для определения кислотности существует несколько титриметрических методов, включая:
- Аргентометрический метод: основан на взаимодействии кислых веществ с раствором серебра. Концентрация кислотности определяется количеством раствора серебра, необходимым для полной нейтрализации.
- Оксидиметрический метод: основан на определении концентрации кислорода в образце за счет его окисления с помощью оксидирующего агента. Концентрация кислотности связана с количеством окислителя, необходимого для окисления.
- Ионометрический метод: основан на определении концентрации ионов водорода (pH) в образце с помощью электронного иономера. Принцип основан на количестве ионов водорода, что определяет степень кислотности образца.
- Комплексонометрический метод: основан на взаимодействии кислых веществ с комплексообразующими веществами. При этом происходит образование стабильных комплексов, которые можно заметить и измерить.
Титриметрические методы определения кислотности являются точными и широко используемыми. Они позволяют получить количественную информацию о содержании кислотных веществ и контролировать качество различных продуктов и материалов.
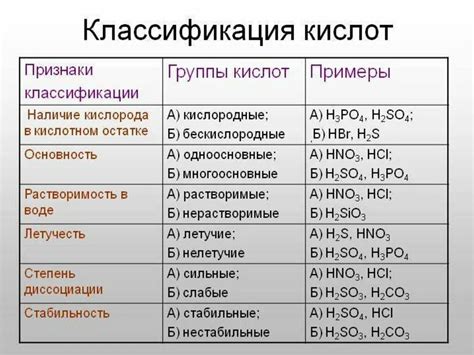
Главные классификации кислот
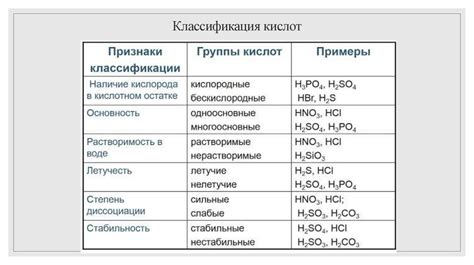
- По способу образования:
- Неорганические кислоты – получаются из неорганических соединений, например, при окислении металлов;
- Органические кислоты – содержат одну или несколько карбоксильных групп и образуются в организмах живых организмов.
- По составу:
- Монобазные кислоты – содержат одну карбоксильную группу;
- Двухбазные кислоты – содержат две карбоксильные группы;
- Полихлорированные кислоты – содержат хлорированные радикалы в молекуле и обладают высокой кислотностью.
- По силе:
- Сильные кислоты – полностью диссоциируются в водном растворе;
- Слабые кислоты – диссоциируют частично в водном растворе;
- Умеренно сильные кислоты – имеют среднюю степень диссоциации.
Классификации кислот помогают определить важные характеристики кислотности, что позволяет более точно и эффективно использовать их в различных химических процессах и приложениях.
Классификация по химическому составу
Кислоты могут быть классифицированы в зависимости от их химического состава. Существуют различные параметры, которые помогают определить кислотность и классифицировать кислоты.
- Органические кислоты: такие кислоты содержат один или более атомов углерода в их молекуле. Примерами органических кислот являются уксусная кислота (CH3COOH) и лимонная кислота (C6H8O7).
- Неорганические кислоты: это кислоты, которые не содержат атомов углерода. Такие кислоты обычно состоят из одного или нескольких атомов водорода и атомов других элементов. Примерами неорганических кислот являются соляная кислота (HCl) и серная кислота (H2SO4).
- Бинарные кислоты: это кислоты, состоящие только из водорода и одного другого элемента. Примерами бинарных кислот являются хлороводородная кислота (HCl) и гидрофторная кислота (HF).
- Оксокислоты: это кислоты, которые содержат один или несколько атомов кислорода в своей молекуле, помимо элемента, с которым они связаны. Примерами оксокислот являются серная кислота (H2SO4) и азотная кислота (HNO3).
Классификация кислот по их химическому составу позволяет упростить их изучение и понимание свойств этих соединений. Эта классификация также может быть полезна для исследования и применения кислот в различных отраслях науки и промышленности.
Классификация по степени кислотности
Кислотность вещества определяется концентрацией водородных (H+) и гидроксильных (OH-) ионов, которые образуются при его диссоциации в воде. Существует несколько основных параметров, по которым можно определить степень кислотности:
1. РН - это мера концентрации водородных ионов в растворе. Вода имеет нейтральный рН и равен 7. Растворы с рН меньше 7 считаются кислотными, а с рН больше 7 - щелочными. Чем ниже рН, тем кислотнее раствор.
2. Кислотные постоянные (Ka) - это величины, которые показывают, насколько хорошо кислотное вещество диссоциирует в воде и образует водородные ионы. Чем больше значение Ka, тем более кислотное вещество.
3. Индикаторы - это вещества, которые меняют свой цвет в зависимости от степени кислотности раствора. Они используются для определения кислотности по цветовой шкале.
4. Кислотный остаток - это атом, группа атомов или ион, который остается после удаления одного или нескольких водородных ионов от кислоты. Чем больше кислотных остатков в молекуле, тем кислотнее она.
Классификация по степени кислотности помогает определить свойства и применение различных кислот и их растворов. Она основана на понятии рН, кислотных постоянных, индикаторах и кислотных остатках, которые позволяют точно измерить их кислотность и использовать в различных областях науки и техники.
Практическое применение классификации кислот
Знание классификации кислот позволяет ученым и химикам более эффективно работать с кислотными соединениями. Используя параметры, такие как pH, константа диссоциации и химический состав, можно определить кислотность соединения и его реакционные свойства.
Одно из практических применений классификации кислот - выбор оптимальной кислоты для конкретной задачи. Например, карбоновые кислоты часто используются в органическом синтезе, а сульфатная кислота - в процессах очистки воды и производства удобрений.
Классификация кислот также находит применение в медицине. Знание свойств кислот помогает в определении и лечении различных заболеваний. Например, соляная кислота в желудочном соке играет важную роль в пищеварении, а молочная кислота может служить показателем определенных заболеваний и физической активности.
Благодаря классификации кислот учеными были открыты новые кислоты и разработаны новые методы их синтеза. Это позволяет создавать новые материалы и вещества с определенными свойствами, которые находят применение в различных индустриальных и научных областях.
Таким образом, классификация кислот играет важную роль в науке, химии и многих других областях. Она помогает ученым и специалистам более точно изучать и применять кислотные соединения, исследовать их свойства и находить новые области применения.



