Оксид цинка, также известный как Zno, является одним из основных неорганических соединений цинка. Этот неорганический оксид имеет широкий спектр интересных свойств и применений. Zno оксид обладает уникальной структурой и химическим составом, что делает его важным объектом исследования в науке и технологии.
Одним из наиболее примечательных свойств оксида цинка является его полупроводниковая природа. Zno оксид является полупроводниковым материалом, который обладает широким запрещенным зоном, что позволяет использовать его в электронных компонентах, таких как диоды и транзисторы. Благодаря своей полупроводниковой природе,Zno оксид также используется в солнечных батареях для преобразования солнечной энергии в электричество.
Naцентры оксида цинка также играют важную роль в его свойствах и применениях. Нацентры, или дефекты кристаллической решетки, могут влиять на электропроводность, светопоглощение и люминесценцию Zno оксида. Особенно интересным свойством Zno является его уникальная способность светиться в ультрафиолетовом диапазоне. Это свойство делает Zno оксид полезным в различных приложениях, таких как светодиоды, OLED дисплеи и оптические сенсоры.
Важным аспектом понимания свойств Zno оксида является изучение его химических реакций. Zno оксид может реагировать с различными веществами, включая кислоты, щелочи и другие металлы. Эти реакции могут привести к образованию новых соединений или изменению свойств оксида цинка. Изучение химических реакций Zno оксида помогает ученым лучше понять его структуру и свойства, а также находить новые применения для этого важного соединения.
Свойства ZnO оксида

Свойства ZnO оксида зависят от его химической структуры и кристаллической решетки. Вот некоторые из основных свойств этого соединения:
- Цвет и прозрачность: ZnO оксид обычно имеет белый цвет, но в зависимости от размера частиц и условий синтеза может быть и желтым, зеленым или синим. Он обладает полупрозрачностью и может быть использован в качестве фильтра в оптических приборах.
- Твердость и хрупкость: ZnO оксид обладает высокой твердостью, что делает его непростительным к материалам типа стекла. Однако он также хрупок, что может вызывать проблемы при обработке.
- Теплопроводность: ZnO оксид обладает высокой теплопроводностью, что делает его хорошим материалом для теплоотвода.
- Электрические свойства: ZnO оксид является полупроводником и обладает положительными и отрицательными электрическими зарядами. Он может быть использован в электронных устройствах, таких как светодиоды и транзисторы.
- Фотокаталитическая активность: ZnO оксид обладает свойствами фотокатализатора, что делает его эффективным при очистке воздуха и воды от различных загрязнений.
- Химическая инертность: ZnO оксид обычно химически инертен, но может реагировать с кислотами и некоторыми другими химическими веществами при высоких температурах.
Знание свойств ZnO оксида позволяет его использовать в различных областях, таких как промышленность, электроника, медицина и окружающая среда.
Физические и химические свойства
Основные физические свойства Zno оксида включают плотность, которая составляет около 5,61 г/см^3, и точку плавления, равную примерно 1975 °C. Тем не менее, Zno оксид обладает очень высокой температурой испарения, которая составляет примерно 1800 °C.
Химически Zno оксид является амфотерным соединением, то есть он образует соли с кислотными оксидами и образует основания с кислотами. Zno оксид также демонстрирует каталитическую активность при реакциях окисления органических соединений.
- Zno оксид не растворяется в воде и слабых кислотах, но растворяется в сильных кислотах, таких как соляная кислота и серная кислота.
- Он обладает свойством фотокатализа, способностью поглощать ультрафиолетовое излучение и превращать его в видимое светлое излучение.
- Zno оксид также проявляет полупроводниковые свойства, включая возможность передвижения электронов и дырок в своей структуре.
- Он имеет ферромагнитные свойства при низких температурах.
- Зно оксид также проявляет способность образовывать стабильные соединения с другими элементами, такими как алюминий, медь, иттрий.
Эти физические и химические свойства делают Zno оксид многогранным материалом с широким спектром применений в различных отраслях науки и техники.
Использование Zno оксида

Zno оксид широко используется в различных областях из-за своих уникальных свойств и химических реакций. Рассмотрим несколько основных областей его применения.
1. Электроника и сенсорика: Zno оксид является перспективным материалом для создания полупроводниковых приборов. Он используется при производстве диодов, светодиодов, транзисторов и других электронных компонентов. Также, благодаря своей чувствительности к газам и свету, Zno оксид применяется в сенсорах.
2. Солнечные батареи: благодаря своим электрическим и оптическим свойствам, Zno оксид используется в солнечных батареях. Он помогает преобразовывать солнечный свет в электрическую энергию.
3. Катализ: Zno оксид является хорошим катализатором во многих химических реакциях. Он используется в производстве пластмасс, лекарственных препаратов, а также в процессе очистки воды и воздуха.
4. Антимикробные свойства: Zno оксид обладает антимикробными свойствами и может использоваться в медицине для борьбы с бактериями и вирусами. Он добавляется в состав мазей, кремов и повязок для лечения различных кожных инфекций.
5. Наноматериалы: Zno оксид является популярным материалом в нанотехнологиях. Использование Zno в наномасштабе позволяет получить материал с улучшенными физическими и химическими свойствами, что находит применение в различных отраслях, включая электронику, медицину и энергетику.
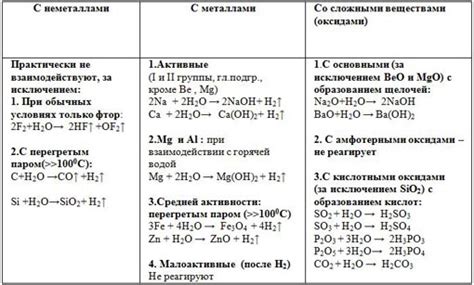
Химические реакции с ZnO оксидом

ZnO оксид обладает различными свойствами и способен вступать во множество химических реакций. Рассмотрим некоторые из них:
1. Реакция с кислотами:
При взаимодействии с кислотами ZnO оксид образует соли и воду. Например, при реакции с соляной кислотой (HCl) образуется хлорид цинка (ZnCl2) и вода:
ZnO + 2HCl → ZnCl2 + H2O
2. Реакция с щелочами:
При реакции с щелочами ZnO оксид образует соли щелочных металлов и воду. Например, при реакции с гидроксидом натрия (NaOH) образуется гидроксид цинка (Zn(OH)2) и натриевая соль:
ZnO + 2NaOH → Zn(OH)2 + Na2O
3. Реакция с кислородом:
ZnO оксид реагирует с кислородом при нагревании и образует цинкат (Zn(ОН)2), который далее диссоциирует в цинкат-ион (Zn2+) и гидроксид-ион (ОН-). Данное свойство делает ZnO полезным при процессах окисления и восстановления.
В общем, ZnO оксид может вступать в множество реакций, образуя различные соединения в зависимости от условий и реагентов, с которыми он взаимодействует.
Реакция с кислотами

Нейтральные и слабощелочные оксиды, такие как ZnO, реагируют с кислотами, образуя соли и воду. Оксид цинка обладает амфотерными свойствами, что означает, что он может реагировать как с кислотами, так и с основаниями.
Реакция ZnO с кислотами происходит следующим образом:
1) С растворимыми кислотами (например, соляной или уксусной) образуются соответствующие соли:
ZnO + 2HCl → ZnCl2 + H2O
ZnO + 2CH3COOH → (CH3COO)2Zn + H2O
2) С нерастворимыми кислотами (например, серной) может образовываться осадок нерастворимой соли:
ZnO + H2SO4 → ZnSO4 + H2O
3) Со сильными кислотами (например, HNO3) ZnO может прореагировать, образуя основание:
ZnO + 2HNO3 → Zn(NO3)2 + H2O
Таким образом, ZnO действует как нейтрализатор сильных и слабых кислот, образуя соли и воду.



