Оксиды являются одними из основных классов химических соединений и играют важную роль во многих процессах и реакциях. Но иногда может возникнуть вопрос - являются ли оксиды кислотами, основаниями или солями?
Оксиды - это химические соединения, состоящие из атомов кислорода и других элементов. Они образуются при соединении кислорода с другими элементами и могут иметь различные свойства и реактивность. Например, оксиды металлов обычно обладают основными свойствами, в то время как оксиды неметаллов обычно являются кислотами.
Также важно отметить, что оксиды могут образовывать соли при реакции с кислотами или основаниями. Например, оксид натрия (Na2O) реагирует с кислотой соляной (HCl) и образует соль - хлорид натрия (NaCl).
Химический состав оксидов
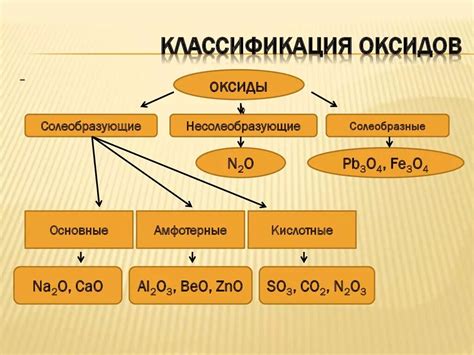
Самым распространенным оксидом является оксид углерода, известный также как угарный газ. Его химическая формула CO показывает, что он состоит из одной молекулы кислорода и одной молекулы углерода.
Другим примером оксида является оксид алюминия, химическая формула которого Al2O3. Он состоит из двух атомов алюминия и трех атомов кислорода.
Оксиды могут быть и многие другие, например, оксиды серы, железа, магния и др. Все они имеют разный химический состав и свойства.
Различные оксиды могут обладать разными свойствами, поэтому они могут использоваться в различных областях науки и технологии. Некоторые оксиды, такие как оксид алюминия, используются в качестве катализаторов или абразивных материалов. Другие оксиды, например оксид железа, могут использоваться в производстве красок или керамики.
| Название оксида | Химическая формула |
|---|---|
| Оксид углерода | CO |
| Оксид алюминия | Al2O3 |
| Оксид серы | SO2 |
| Оксид железа | Fe2O3 |
| Оксид магния | MgO |
Оксиды - связующее звено химических соединений
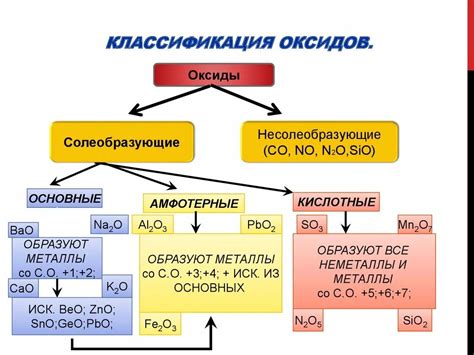
Оксиды представляют собой химические соединения, состоящие из одного или нескольких атомов кислорода, соединенных с атомами других элементов. Кислород в оксидах имеет отрицательный заряд, а элементы, с которыми он соединен, могут иметь как положительный, так и отрицательный заряд.
Оксиды образуются в результате окисления элементов или соединений воздухом или кислородом. Многие из них являются неметаллическими соединениями, такими как оксиды углерода (СО, СО2), оксиды азота (NO, NO2) и оксиды серы (SO2, SO3). Другие оксиды могут быть металлами и полуметаллами, такими как оксиды железа (Fe2O3, Fe3O4), оксиды алюминия (Al2O3) и оксиды кремния (SiO2).
В химических реакциях оксиды могут взаимодействовать как с кислотами, так и с основаниями, образуя соли или воду. Если оксид реагирует с кислотой, то происходит образование соли и воды. Например, оксид железа (III) и серная кислота реагируют следующим образом:
Fe2O3 + 3H2SO4 → 2Fe(SO4)3 + 3H2O
Если оксид реагирует с основанием, то образуется соль и вода. Например, оксид кальция (CaO) и гидроксид аммония (NH4OH) реагируют следующим образом:
CaO + 2NH4OH → Ca(NO3)2 + 2H2O
Таким образом, оксиды являются важным связующим звеном между различными группами химических соединений. Они выполняют роль как соли, основания и кислоты в различных химических реакциях, обеспечивая их правильное протекание и образование новых соединений.
Оксиды - основной класс химических соединений

Оксиды могут быть как кислотными, так и основными соединениями. Кислотные оксиды образуются при соединении неметалла с кислородом и могут образовывать кислотные растворы. Они часто проявляют сильные кислотные свойства и могут реагировать с основаниями, образуя соли и воду.
Основные оксиды образуются при соединении металла с кислородом и обладают щелочными свойствами. Они реагируют с кислотами, образуя соли и воду. Основные оксиды часто используются в промышленности для производства щелочей и других продуктов.
Некоторые оксиды, такие как оксид углерода (СО) и оксид азота (NO), являются газами и имеют важное значение для атмосферной химии и загрязнения окружающей среды. Другие оксиды, такие как оксид кальция (CaO) и оксид алюминия (Al2O3), являются твердыми веществами и широко используются в строительстве и промышленности.
Важно отметить, что оксиды могут иметь различные степени окисления и играть разные роли в химических реакциях. Они могут быть как окислителями, так и восстановителями и могут проявлять кислотные, основные или нейтральные свойства.
В связи с их широким распространением и разнообразием свойств, оксиды являются основой многих химических процессов и играют важную роль в нашей повседневной жизни.
Оксиды - основание вряд ли

Хотя оксиды содержат кислород, их нельзя называть кислотами или солями. Как правило, оксиды обладают щелочной или амфотерной природой - они реагируют с водой, образуя щелочные растворы или основания.
Например, оксид натрия (Na2O) образует гидроксид натрия (NaOH) при контакте с водой. Гидроксид натрия является сильным щелочным раствором и широко используется в промышленности и быту.
Оксиды также могут образовывать основания при реакции с кислотами, например, оксид натрия реагирует с хлороводородной кислотой, образуя хлорид натрия и воду:
Na2O + 2HCl → 2NaCl + H2O
Вместе с тем, оксиды не являются основаниями в строгом смысле этого термина. Основание - это химическое соединение, которое способно принимать протоны от кислоты. Оксиды могут реагировать с кислотами, но не принимают протоны в такой же степени, как, например, гидроксиды.
Таким образом, оксиды не являются чистыми основаниями, но они могут образовывать основания в условиях определенных реакций и являются важными сырьевыми материалами и реагентами в химической промышленности и научных исследованиях.
Свойства и химические реакции оксидов

Оксиды представляют собой химические соединения состоящие из кислорода и одного или нескольких других элементов. Они могут иметь различные степени окисления и обладают разнообразными свойствами и химическими реакциями.
В зависимости от химического свойства, оксиды могут выполнять роль оснований, кислот или солей. Это связано со степенью окисления кислорода, который является основным составляющим оксидов.
Оксиды, в которых кислород имеет степень окисления -2, обычно являются основаниями. Они способны реагировать с кислотными соединениями, образуя соль и воду. Например, оксид натрия (Na2O) реагирует с кислотой серной (H2SO4), образуя соль сернокислый натрий (Na2SO4) и воду (H2O).
Оксиды с положительной степенью окисления кислорода чаще всего выступают в роли кислот. Они обладают кислотными свойствами и могут реагировать с основаниями, образуя соль и воду. Например, оксид серы (SO2) реагирует с гидроксидом натрия (NaOH), образуя соль сульфит натрия (Na2SO3) и воду (H2O).
Однако, некоторые оксиды могут демонстрировать свойства и реакции как кислоты, так и основания. Например, оксид алюминия (Al2O3) может реагировать и с кислотами, и с основаниями.
| Свойства оксидов | Химические реакции |
|---|---|
| Могут выступать в роли кислот, оснований или солей | Взаимодействуют с кислотами и основаниями |
| Могут иметь различные степени окисления кислорода | Образуют соли и воду при реакции с кислотами или основаниями |
| Могут реагировать как с кислотами, так и с основаниями | Могут образовывать различные соли и воду в зависимости от реагента |
Таким образом, оксиды могут проявлять разнообразные свойства и участвовать в различных химических реакциях, в зависимости от их состава и степени окисления кислорода.
Оксиды - кислотообразующие соединения

Оксиды играют важную роль в химии, поскольку многие из них являются кислотообразующими соединениями. Как правило, оксиды реагируют с водой, образуя кислоты. Например, оксид серы (SO2) реагирует с водой, образуя серную кислоту (H2SO4).
Оксиды также могут растворяться в воде, образуя основания. Например, оксид натрия (Na2O) растворяется в воде, образуя гидроксид натрия (NaOH), который является сильным щелочным раствором.
Оксиды могут быть использованы в различных отраслях промышленности и научных исследованиях. Например, оксиды кремния (SiO2) широко используются в производстве стекла, керамики и полимеров. Оксиды железа (Fe2O3) используются в производстве красок и пигментов. Оксиды свинца (PbO) используются в производстве стекла и аккумуляторов.
| Оксид | Формула | Примеры |
|---|---|---|
| Оксид азота(II) (азотная смесь) | NO, N2O | NO - использование в производстве азотной кислоты; N2O - смазка для дистилляционных колонн |
| Оксид азота(IV) (азотная смесь) | NO2 | Используется в производстве азотной кислоты и как окислитель |
| Оксид азота(V)(азотная кислота) | N2O5 | Используется в производстве азотной кислоты |
Оксиды - способны образовывать соли

Одной из основных химических реакций, связанных с оксидами, является их способность образовывать соли. Когда оксиды реагируют с кислотами, происходит образование солей.
Это происходит в результате процесса, известного как нейтрализация. Во время нейтрализации оксиды выступают в роли оснований, а кислоты - в роли кислот.
В реакции между основанием (оксидом) и кислотой образуется соль и вода. Соль, в свою очередь, состоит из катиона металла из оксида и аниона кислоты.
Образование солей при реакции с оксидами может иметь разные виды. Например, если реакция происходит между оксидом металла и кислотой, образуется соль металла и вода.
Таким образом, оксиды могут выполнять роль оснований в химических реакциях и образовывать соли при взаимодействии с кислотами. Этот процесс является важным аспектом химии и помогает понять разнообразные свойства оксидов.
Оксиды - влияют на кислотно-щелочной баланс
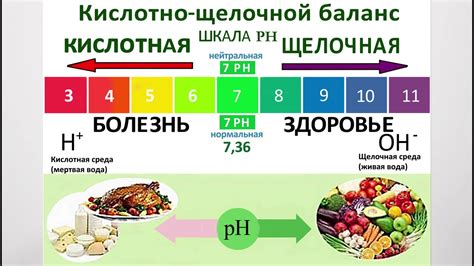
Оксиды, в зависимости от своих химических свойств, могут быть как основаниями, так и кислотами. Это зависит от реакций оксидов с водой.
Если оксид реагирует с водой и образует гидроксидное основание, то он называется основным оксидом. Примером такого оксида является оксид кальция (CaO), который реагирует с водой, образуя гидроксид кальция (Ca(OH)₂).
Если оксид реагирует с водой и образует кислотное вещество, то он называется кислотным оксидом. Примером такого оксида является оксид серы (SO₃), который реагирует с водой, образуя серную кислоту (H₂SO₄).
Кроме того, оксиды могут образовывать соли при реакции с кислотами. В результате таких реакций образуются ионы, которые влияют на кислотно-щелочной баланс растворов.
Таким образом, оксиды играют важную роль в химических реакциях и могут влиять на кислотно-щелочной баланс, образуя основания, кислоты или соли. Изучение свойств оксидов помогает понять принципы взаимодействия веществ и их влияние на окружающую среду.



