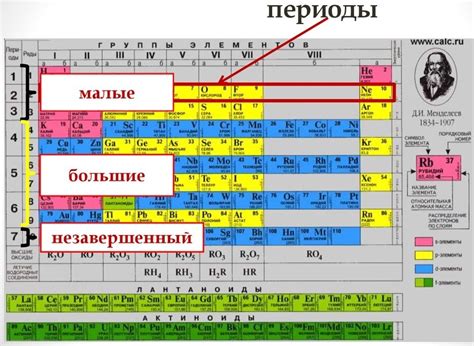
Периодическая система химических элементов – удивительное открытие ученых, которое стало основой для современной химии. Всего в периодической системе 7 периодов, которые расположены горизонтально. Каждый период начинается с новой энергетической оболочки и атомным радиусом. Но не только этим характеризуются периоды – каждый из них имеет свои особенности и химические закономерности.
Номер периода играет важную роль в определении свойств элементов. С каждым новым периодом, энергетические уровни атома становятся все ближе друг к другу, что приводит к изменению химических свойств элементов. Это связано с волновыми свойствами электронов, которые находятся на разных энергетических уровнях и обладают разным силовым воздействием на орбитали следующего периода.
Номер периода также определяет размер атомов элементов. С каждым следующим периодом атомные радиусы увеличиваются, что связано с добавлением новой энергетической оболочки. Это обуславливает различия в химической активности элементов разных периодов. Более маленькие атомы имеют большую электроотрицательность и кислотность, чем более крупные элементы.
Значение номера периода в химии:
Номер периода также оказывает влияние на реакционную способность элемента. Элементы, находящиеся в одном периоде, имеют сходные свойства и образуют группы в таблице Менделеева. Как правило, с ростом номера периода увеличивается размер атома и его радиус, а также увеличивается количество электронов и электронных оболочек.
Важно отметить, что химические свойства элемента определяются не только его номером периода, но и его номером группы. Это связано с тем, что элементы одной группы имеют одинаковое число электронов на внешней энергетической уровне, что обуславливает их сходство в реакциях и химических свойствах.
Вещества и их свойства

Химические элементы, представленные в периодической таблице, образуют разнообразные вещества, которые обладают различными свойствами. В зависимости от своей химической структуры и атомной композиции, вещества могут быть металлами, полупроводниками, неметаллами или инертными газами.
Металлы характеризуются силой и проводимостью электричества и тепла. Они обладают высокой пластичностью и позволяют легко проводить различные механические операции, такие как гнуть, ковать и вытягивать. Металлы образуют ионные соединения с неметаллами, в результате чего образуются соли
Неметаллы, наоборот, обычно хрупкие и не проводят электричество и тепло так хорошо, как металлы. Они образуют ковалентные соединения друг с другом или с металлами, образуя молекулы.
Полупроводники - это материалы, обладающие свойствами и металлов, и неметаллов. Они обладают проводимостью, близкой к проводимости металлов, но при этом обладают также и полупроводимостью, характерной для неметаллов.
Инертные газы, такие как гелий и неон, обычно не образуют химические соединения с другими элементами, так как их электронная конфигурация делает их стабильными и малоактивными. Они широко используются в научных и технических областях для создания защитной атмосферы или заполнения электрических ламп.
Вещества могут обладать разнообразными физическими свойствами, такими как температура плавления, вязкость, плотность и состояние материи (твердое, жидкое или газообразное). Они также обладают химическими свойствами, такими как способность проявлять реакции окисления, взаимодействовать с другими веществами и образовывать новые соединения.
Исследование веществ и их свойств является основой химической науки и имеет широкое применение в различных областях, от медицины до промышленности.
Электронная структура и реактивность

Электронная структура атомов, определяемая количеством электронов в каждом энергетическом уровне и подуровне, играет важную роль в определении их химической реактивности.
Наиболее стабильные элементы обычно имеют заполненные энергетические уровни и подуровни, что обеспечивает им низкую энергию и высокую стабильность. Например, инертные газы, такие как гелий и неон, имеют полностью заполненные энергетические уровни и подуровни, и поэтому они обладают минимальной химической реактивностью.
С другой стороны, элементы с неполностью заполненными энергетическими уровнями и подуровнями имеют высокую реактивность и обладают способностью образовывать химические связи. Например, восемь электронов на внешнем энергетическом уровне кислорода делают его тяглым к электроотрицательным элементам, таким как водород и алкалии, и способным образовывать соединения.
Также, энергия первого и последующих ионизаций атома, а также его атомный радиус, влияют на реактивность элементов. Ионизационная энергия определяет сколько энергии необходимо для удаления электрона из атома, тогда как атомный радиус связан с вероятностью взаимодействия атома с другими элементами.
В целом, электронная структура элементов химического периодического столба определяет их реактивность и способность образовывать соединения с другими элементами. Понимание электронной структуры и реактивности элементов позволяет химикам прогнозировать и объяснять их химическое поведение и использовать их в различных химических реакциях и процессах.
Группы и характеристики элементов

В периодической таблице химических элементов, элементы представлены в порядке возрастания атомного номера. Они разделены на 18 групп, которые имеют свои уникальные характеристики и свойства.
Группа 1 элементов, также известных как щелочные металлы, включает литий, натрий, калий и другие. Они обладают низкой плотностью, низкой точкой плавления и реагируют с водой, образуя щелочные растворы.
Группа 2 элементов, или щелочноземельные металлы, включает бериллий, магний, кальций и другие. Они также имеют низкую плотность и низкую точку плавления, но образуют менее реактивные соединения, чем группа 1.
Группа 17 элементов, также известных как галогены, включает фтор, хлор, бром и другие. Они обладают высокой электроотрицательностью и реагируют с многими другими элементами, образуя соли.
Группа 18 элементов, или инертные газы, включает гелий, неон, аргон и другие. Они обладают низкой реактивностью и практически не образуют химических соединений.
Это лишь некоторые из основных групп элементов, каждая из которых имеет свои характеристики и свойства. Изучение этих групп и понимание их взаимодействия является ключевым элементом в химии и имеет применение во многих областях науки и технологии.
Взаимодействие веществ и реакции

Реакции между веществами могут быть эндотермическими, то есть сопровождающимися поглощением энергии, или экзотермическими, когда выделяется энергия. Некоторые реакции могут проходить очень быстро, почти мгновенно, а другие требуют продолжительного времени для завершения.
- Химические реакции могут быть спонтанными, когда они происходят естественным образом без внешнего воздействия, или индуцированными, когда их совершение требует активации инициатором.
- Взаимодействие веществ может приводить к образованию различных продуктов, включая газы, жидкости или твердые вещества.
- Многие реакции в природе и технологии имеют непосредственное практическое значение. Например, синтез различных соединений и материалов, выработка энергии, очистка отходов и продуктов сгорания.
Понимание взаимодействия веществ и реакций имеет большое значение для различных отраслей промышленности, медицины, пищевой промышленности и других областей жизни. Знание основных реакций и их последствий помогает разработке новых материалов, лекарств, улучшению процессов производства и сохранению окружающей среды.
Изучая взаимодействие веществ и реакции, химики расшифровывают многочисленные тайны и законы, которые управляют миром на молекулярном уровне и позволяют создавать новые вещества и материалы, улучшать жизнь и вести прогрессивное развитие человечества.



