Химия – это наука, изучающая строение, свойства и превращения различных веществ. В химических реакциях участвуют атомы, которые обладают зарядом и состоят из электронов, протонов и нейтронов. Один из ключевых понятий в химии – спаренные и неспаренные электроны.
Спаренные электроны – это пары электронов, находящиеся в одной атомной орбитали и имеющие противоположный спин. Такие электроны образуют электронные облака, в которых протоны и нейтроны находятся в ядре. Обычно валентные оболочки атомов заполняются парами электронов, что является наиболее стабильным состоянием для атома.
Однако, в некоторых случаях, атомы могут обладать неспаренными электронами. Неспаренные электроны – это электроны, находящиеся в одиночной атомной орбитали и не имеющие пары с противоположным спином. Такие электроны обладают повышенной реакционной способностью, так как они могут связываться с другими атомами или молекулами для образования химических связей.
Примером неспаренного электрона является атом кислорода (O), который имеет два неспаренных электрона в своей внешней оболочке. Благодаря этим неспаренным электронам атомы кислорода могут образовывать связи с другими атомами, например, в молекулах воды или озона. Неспаренные электроны также играют важную роль в реакциях окисления и восстановления, а также в магнетизме и разнообразных химических процессах.
Значение неспаренных электронов в химии
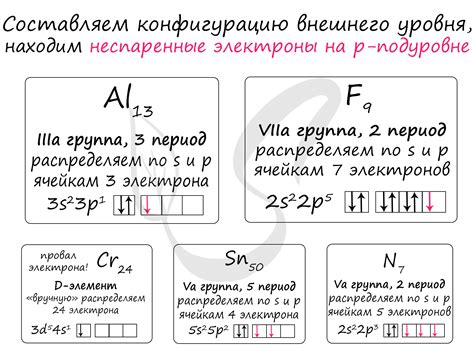
Неспаренные электроны имеют важное значение в химии и играют ключевую роль в различных химических процессах и связях. Они влияют на структуру и свойства атомов и молекул, а также на их реактивность и взаимодействия с другими веществами.
Неспаренные электроны могут участвовать в химических реакциях, образуя новые связи или разрывая существующие. Они могут быть донорами или акцепторами электронов, что делает их важными в реакциях окисления-восстановления и образовании комплексных соединений. Примером таких реакций может служить образование радикалов, которые могут быть очень реактивными.
Также, неспаренные электроны могут влиять на силу и тип межмолекулярных взаимодействий. Например, электронный спин неспаренного электрона может создавать магнитное поле, которое влияет на взаимодействие с другими магнитными веществами.
Неспаренные электроны также имеют большое значение в области органической химии. Они могут определить химическую активность молекулы, ее реакционную способность и возможность образования связей. Они могут служить ключевыми фрагментами в органических реакциях, определять стереохимические свойства молекулы и влиять на ее электрофильность или нуклеофильность.
| Примеры молекул с неспаренными электронами: |
|---|
| Радикалы (свободные радикалы, реакционные радикалы) |
| Карбаноны |
| Карбены |
| Карбанионы |
Примеры неспаренных электронов
1. Нитроксильный радикал (NO•):
Нитроксильный радикал – это неорганический радикал, содержащий неспаренный электрон. Он представляет собой одну из форм окисленной формы азота (NO). Неспаренный электрон в нитроксильном радикале делает его реакционноспособным и реактивным. Этот радикал является важным промежуточным продуктом в различных химических реакциях и играет важную роль в окислительно-восстановительных процессах.
2. Радикал метилового спирта (•CH3):
Радикал метилового спирта – это органический радикал, состоящий из неспаренного электрона и трех углеродных атомов. Неспаренный электрон в радикале метилового спирта делает его реакционноспособным и подверженным свободным радикальным реакциям. Радикал метилового спирта широко используется в органической химии для проведения различных реакций и синтеза органических соединений.
3. Радикал динитрогена (•N2):
Радикал динитрогена – это неорганический радикал, состоящий из двух атомов азота и неспаренного электрона. Радикал динитрогена стабилен и обладает высокой энергией. Он широко используется в промышленности для производства азотной кислоты и других химических соединений.
Эти примеры демонстрируют важность неспаренных электронов в химических реакциях и их участие в образовании и разрушении химических связей.
Роль неспаренных электронов в химических реакциях

Неспаренные электроны играют важную роль в химических реакциях, влияя на свойства и взаимодействия атомов и молекул. Когда атом или молекула имеют неспаренные электроны в своей валентной оболочке, они становятся реакционно активными и могут изменять свою структуру и связи с другими атомами или молекулами.
Неспаренные электроны могут быть заполнены в химических реакциях, образуя новые связи, или они могут быть обладателями свободных радикальных электронов, которые могут реагировать с другими веществами. Радикалы с неспаренными электронами часто проявляют реакционную активность и способны к изменению структуры и свойств вещества.
Неспаренные электроны также могут образовывать химические связи с другими атомами или молекулами. Например, при образовании ковалентной связи атомы делят пару электронов, чтобы у каждого атома был полностью заполненный электронный пассив. Неспаренные электроны могут быть использованы для образования таких связей, что может привести к образованию новых соединений и проявлению новых свойств.
Кроме того, неспаренные электроны играют важную роль в химических реакциях, связанных с обменом электронами. В реакциях окисления-восстановления неспаренные электроны могут передаваться от одной молекулы к другой, меняя их степень окисления. Это может привести к образованию новых продуктов реакции и изменению свойств вещества.
Таким образом, неспаренные электроны играют важную роль в различных химических реакциях, определяя структуру и свойства вещества, а также влияя на его реакционную активность.
Объяснение явления неспаренных электронов

Неспаренными электронами называют электроны, которые остаются непарными в атоме или молекуле. Такое явление может возникать при нарушении правил заполнения электронных оболочек в химических элементах.
Основополагающее правило заполнения электронных уровней и оболочек – правило Ауфбау. Согласно ему, электроны заполняют энергетические уровни поочередно, начиная с наименьших энергий. Это означает, что сначала заполняются s-орбитали, затем p-орбитали, d-орбитали и f-орбитали. Каждая орбиталь может вместить определенное количество электронов.
Однако иногда происходит нарушение этого правила и одна из орбиталей остается неполностью заполненной. В результате у атома или молекулы появляются неспаренные электроны, которые являются необычными и имеют важное значение в химических реакциях и свойствах вещества.
Неспаренные электроны обладают высокой реакционноспособностью, так как они могут образовывать химические связи с другими атомами или молекулами для обретения полной электронной оболочки. Это объясняет, почему вещества с неспаренными электронами обладают особыми свойствами, такими как магнетизм или радикальность.
Примерами веществ, содержащих неспаренные электроны, являются радикалы органических соединений, такие как радикалы алкилов или ароматических соединений. Другой пример – кислородный радикал, содержащий неспаренные электроны, который играет важную роль в биологических процессах и окислительно-восстановительных реакциях.
Исследование явления неспаренных электронов имеет большое значение в химии и науке в целом, так как позволяет понять и объяснить многие химические свойства и реакции веществ, и является основой для разработки новых материалов и лекарственных препаратов.



