Молекулы – это основные строительные блоки вещества. Все вещества вокруг нас, будь то вода, воздух или железо, состоят из множества молекул, которые взаимодействуют друг с другом.
Межмолекулярные силы – это силы притяжения и отталкивания между молекулами вещества. Они определяют физические свойства вещества, такие как плотность, температура плавления и испарения, скорость реакций и состояние вещества – твердое, жидкое или газообразное.
В разных веществах действуют разные межмолекулярные силы. Например, вода образует водородные связи между молекулами, что делает ее жидкой при комнатной температуре и позволяет ей обладать высокой теплопроводностью. В то же время, вещества, состоящие из простых молекул, таких как кислород и азот, имеют низкие точки плавления и кипения, так как межмолекулярные силы в них слабые.
Взаимодействие между молекулами вещества происходит благодаря электромагнитным силам. Положительные и отрицательные заряды молекул притягиваются друг к другу, создавая силы притяжения. В то же время, заряды одинакового знака отталкиваются, создавая силы отталкивания.
Структура и взаимодействие частиц в веществе

Межчастицные взаимодействия - это силы, действующие между различными частицами. Они определяют основные свойства вещества, такие как его агрегатное состояние, плотность, температура плавления и кипения. Межчастицные взаимодействия делятся на четыре основных типа: ионно-дипольное, дипольно-дипольное, ван-дер-ваальсовы силы и ковалентные связи.
Ионно-дипольное взаимодействие происходит между ионом и диполем и характерно для ионных веществ, таких как соли. Дипольно-дипольное взаимодействие возникает между двумя диполями с разноименными зарядами и влияет на свойства полярных молекул. Ван-дер-ваальсовы силы - слабое притяжение между нейтральными молекулами и важно для газов и некоторых слабо полярных веществ. Ковалентные связи - это наиболее сильные химические связи между атомами в молекуле.
Внутричастичные связи представляют собой силы, которые держат атомы или ионы внутри молекулы. Они могут быть ковалентными, ионными или металлическими связями, в зависимости от типа вещества. Ковалентные связи образуются путем обмена электронами между атомами и характерны для молекулярных веществ. Ионные связи образуются путем передачи электрона от одного атома к другому и характерны для ионных веществ. Металлические связи образуются между положительно заряженными металлическими ионами и свободными электронами и характерны для металлов.
Все эти взаимодействия определяют физические и химические свойства вещества, его структуру и связи между частицами. Понимание структуры и взаимодействия частиц помогает нам понять свойства вещества и применять их в различных областях науки и техники.
| Тип взаимодействия | Характеристики | Примеры веществ |
|---|---|---|
| Ионно-дипольное | Существенное влияние на свойства ионных растворов | Соль (NaCl), кислоты, щелочи |
| Дипольно-дипольное | Влияет на свойства полярных молекул | Вода (H2O), спирты |
| Ван-дер-ваальсовы силы | Влияют на свойства газов и слабо полярных веществ | Водород (H2), азот (N2), нефть |
| Ковалентные связи | Определяют структуру молекулы | Метан (CH4), этилен (C2H4) |
Молекулярное строение и межмолекулярные силы
Молекулярное строение вещества определяет его физические и химические свойства. Вся материя состоит из атомов и молекул. Атомы объединяются в молекулы, которые, в свою очередь, образуют вещества. Молекулярное строение зависит от типа атомов, присутствующих в молекуле, и способа, которым они связаны.
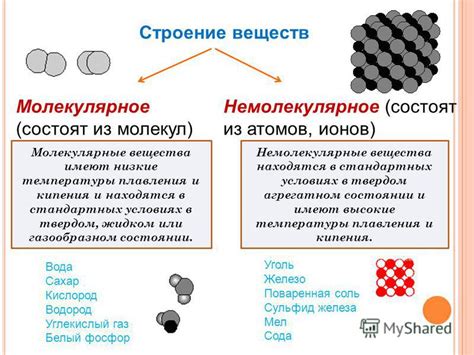
Межмолекулярные силы – это слабые силы, действующие между молекулами. Они определяют физические свойства вещества, такие как температура плавления и кипения, плотность и вязкость. Межмолекулярные силы могут быть дипольно-дипольными, дисперсионными и водородными.
- Дипольно-дипольные силы возникают между молекулами, в которых есть полярные связи. В таких молекулах атомы имеют разную электроотрицательность, что приводит к неравномерному распределению электронов. Образование положительных и отрицательных зарядов в молекуле приводит к возникновению электростатических взаимодействий.
- Дисперсионные силы, также известные как силы Ван-дер-Ваальса, возникают между неполярными молекулами. В неполярных молекулах электроотрицательность атомов одинакова, но электроны все равно могут временно неравномерно распределиться, создавая моментарные диполи.
- Водородные связи возникают между молекулами, в которых присутствует атом водорода, связанный с атомом азота, кислорода или фтора. Водородные связи являются наиболее сильными межмолекулярными силами и играют важную роль во многих биологических процессах.
Межмолекулярные силы влияют на состояние вещества и его поведение в различных условиях. Они определяются физическими и химическими свойствами вещества, а также внешними факторами, такими как температура и давление. Понимание молекулярного строения и межмолекулярных сил помогает объяснить множество явлений и процессов, происходящих в мире вещества.
Фазовые переходы и характер изменения межмолекулярных взаимодействий
Фазовые переходы в веществе сопровождаются изменением состояния межмолекулярных взаимодействий. В зависимости от условий температуры и давления, молекулы вещества могут формировать различные структуры и обладать разными степенями свободы.
Характер изменения межмолекулярных взаимодействий во время фазовых переходов определяется силой притяжения или отталкивания между молекулами. При повышении температуры, силы притяжения обычно ослабевают, что позволяет молекулам двигаться более свободно и преодолевать силу притяжения между собой. Это приводит к изменению структуры вещества и, как следствие, к изменению его физических свойств.
Например, при плавлении вещества происходит фазовый переход из твердого состояния в жидкое. В этом случае силы притяжения между молекулами уменьшаются до такой степени, что твердое вещество теряет свою упорядоченную структуру и принимает форму жидкости.
Взаимодействия между молекулами также играют важную роль при конденсации и испарении вещества. При конденсации, т.е. переходе из газообразного состояния в жидкое, молекулы газа находятся настолько близко друг к другу, что силы притяжения становятся преобладающими и приводят к образованию жидкости. При испарении жидкости, наоборот, силы отталкивания между молекулами превышают силы притяжения, и молекулы расходятся, принимая форму газа.
Изменение межмолекулярных взаимодействий также связано с изменением физических свойств вещества. Например, при повышении температуры и изменении структуры вещества, его плотность, теплопроводность, вязкость и другие свойства могут изменяться. Это объясняется тем, что различные структуры и характеры межмолекулярных взаимодействий обусловливают разные способы передачи энергии и движения частиц вещества.
Таким образом, фазовые переходы и изменение межмолекулярных взаимодействий являются важной составляющей понимания поведения вещества при различных условиях и позволяют объяснить множество свойств и превратностей, которые мы наблюдаем в ежедневной жизни.
Диффузия и перемещение молекул вещества
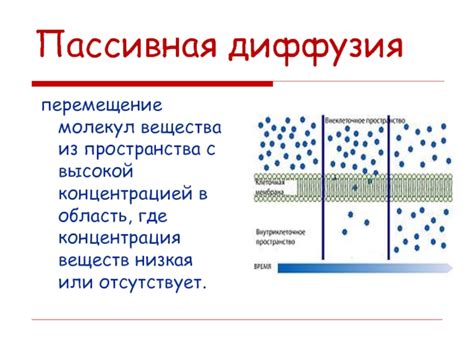
При диффузии молекулы вещества перемещаются от области с более высокой концентрацией к области с более низкой концентрацией. Данный процесс обусловлен случайными столкновениями молекул, что приводит к равномерному распределению вещества в пространстве.
Диффузия играет важную роль во многих процессах, например в процессе дыхания, если речь идет о газах, в смешении растворов или проникновении веществ через мембраны. Она особенно активна при повышенных температурах и увеличении концентрации вещества.
Вещество, которое распространяется в процессе диффузии, называется диффузантом или перемещающимся компонентом. При этом в окружающем пространстве создается градиент концентрации – разность концентраций между двумя областями. Благодаря этому градиенту молекулы диффузанта перемещаются до тех пор, пока концентрации не выравняются.
Скорость диффузии зависит от различных факторов, включая температуру, концентрацию, вязкость среды и свойства молекулы. Чем выше температура, тем быстрее происходит диффузия. Также, чем больше разница в концентрации, тем эффективнее перемещение молекул.
Тепловое движение и колебания молекул

Молекулы вещества находятся в непрерывном движении из-за тепловой энергии, которая присутствует в окружающей среде. Это движение называется тепловым движением.
Вещество состоит из атомов и молекул, которые воздействуют друг на друга. В результате этого взаимодействия происходят колебания молекул, которые проявляются в изменении расстояния между ними. Колебания молекул влияют на многие свойства вещества, такие как его объем, плотность, температура и тд. Колебания также приводят к распределению тепловой энергии внутри вещества и передаче ее в виде тепла.
Таким образом, тепловое движение и колебания молекул играют важную роль в физических свойствах вещества и его поведении в различных условиях.
Кристаллическая решетка и свойства кристаллических веществ
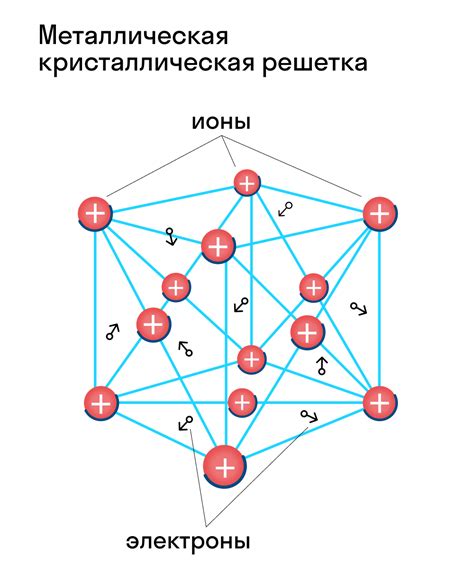
Свойства кристаллических веществ напрямую зависят от их кристаллической решетки. Кристаллические вещества обладают высокой степенью упорядоченности и строго определенными регулярными геометрическими формами. Их свойства, такие как прочность, твердость, прозрачность, оптическая активность и электрическая проводимость, зависят от способа упорядочения молекул внутри решетки.
Кристаллические вещества могут образовывать различные типы кристаллических решеток, такие как кубическая, тетрагональная, гексагональная и другие. В каждом типе решеток молекулы упорядочены в определенном порядке и формируют различные структуры.
Прочность кристаллических веществ обусловлена их регулярным упорядочением молекул. Кристаллическая решетка позволяет молекулам быть более плотно упакованными, что обеспечивает устойчивость и прочность материала.
Твердость кристаллических веществ определяется степенью взаимодействия между атомами, ионами или молекулами в решетке. Если взаимодействие между молекулами сильное, то кристаллическое вещество будет более твердым. Если взаимодействие слабое, то вещество будет менее твердым.
Оптическая активность кристаллических веществ проявляется в их способности поворачивать плоскость поляризованного света при прохождении через них. Это свойство обычно связано с несимметричной атмосферой в решетке.
Электрическая проводимость кристаллических веществ зависит от наличия свободных электронов или заряженных частиц в решетке. Некоторые кристаллические вещества обладают хорошей электрической проводимостью, а некоторые – являются изоляторами.
Таким образом, кристаллическая решетка играет важную роль в определении свойств и характеристик кристаллических веществ. Изучение решетки и ее влияния на свойства веществ позволяет более глубоко понять природу материи и применить это знание в различных областях, включая материаловедение, химию и физику.



