Один из ключевых аспектов химии - диссоциация веществ на ионы. Диссоциация - это процесс разделения вещества на ионы при растворении в воде или плавлении. Некоторые соединения диссоциируют полностью, тогда как другие остаются неизменными. Узнать, какое вещество диссоциирует, а какое нет, поможет понять основные принципы химии и как происходят химические реакции.
Вода является уникальным растворителем и служит основой для большинства реакций диссоциации. Когда соединение диссоциирует, положительно заряженные ионы (катионы) и отрицательно заряженные ионы (анионы) разделяются и растворяются в воде. Некоторые ионы являются хорошо растворимыми и диссоциируют полностью, создавая большое количество ионов в растворе, тогда как другие слабо растворяются и диссоциируют только частично.
Определение того, диссоциирует ли вещество полностью или нет, зависит от его химической структуры и свойств. Сильные электролиты полностью диссоциируются в ионы, образуя множество ионов в растворе. Сюда относятся серные и соляные кислоты, щелочи и большинство солей. С другой стороны, слабые электролиты диссоциируют частично, образуя меньшее количество ионов. К ним относятся уксусная кислота и аммиак.
Вещества, диссоциирующие на ионы
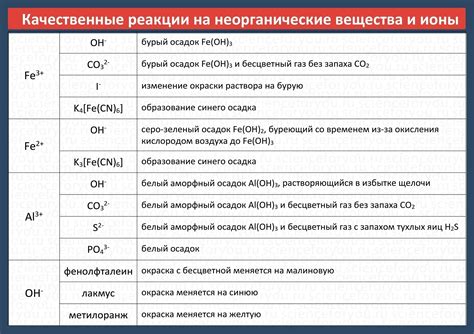
Существует несколько типов веществ, которые диссоциируют на ионы:
- Электролиты: это вещества, которые диссоциируют полностью или частично на ионы при растворении в воде. Примеры электролитов включают соли, кислоты и щелочи.
- Кислоты: это вещества, которые диссоциируют на ионы в водном растворе, предоставляя положительные ионы водорода (H+) и отрицательные ионы. Некоторые примеры кислот включают соляную, серную и уксусную кислоты.
- Щелочи: это вещества, которые диссоциируют на ионы в водном растворе, обеспечивая положительные ионы и отрицательные ионы гидроксида (OH-). Примеры щелочей включают гидроксид натрия и гидроксид калия.
- Соли: это вещества, состоящие из положительных и отрицательных ионов. При растворении соли диссоциируют на эти ионы. Например, хлорид натрия (NaCl) диссоциирует в водном растворе на ионы натрия (Na+) и ионы хлорида (Cl-).
Диссоциация на ионы является важным процессом в растворах и играет роль в химических реакциях, электролизе и других аспектах химии.
Вещества, не диссоциирующие на ионы

Не все вещества способны диссоциировать на ионы в растворах. Вот некоторые примеры веществ, не проявляющих свойства диссоциации:
Молекулярные соединения: Большинство молекулярных соединений не образуют ионов в растворах. Например, кислород, вода, углекислый газ и многие органические соединения не диссоциируют на ионы в водных растворах.
Ковалентные сеточные соединения: Вещества, образующие ковалентные сетки, такие как алмаз и кварц, не диссоциируют на ионы в растворах. Они сохраняют свою ковалентную структуру и не образуют ионных связей.
Эдельгейны: Эдельгейны - это вещества, в которых атомы образуют ионные связи, но не диссоциируют на ионы в растворах. Например, сера и фосфор образуют ионные связи, но остаются недиссоциированными в водных растворах.
Некоторые кислоты и основания: Некоторые слабые кислоты и основания не диссоциируют полностью на ионы в растворах. Например, уксусная кислота (CH3COOH) и аммоний (NH4) образуют лишь небольшое количество ионов.
Важно отметить, что диссоциация на ионы может зависеть от различных факторов, таких как растворитель, температура и концентрация вещества. Поэтому, некоторые вещества могут диссоциировать на ионы в определенных условиях, но не в других.
Процесс диссоциации на ионы

Диссоциативные вещества способны распадаться на ионы при взаимодействии с растворителем или в химических реакциях. Например, кислоты, основания и соли могут диссоциировать на ионы при растворении в воде. В случае кислот, происходит диссоциация на водородные ионы и анионы, а в случае оснований - на гидроксидные ионы и катионы. Диссоциативные вещества обычно образуют электролитические растворы, способные проводить электрический ток.
Недиссоциативные вещества не растворяются в воде и не распадаются на ионы, поэтому они не образуют электролитические растворы. Примерами недиссоциативных веществ могут быть большинство органических соединений, таких как углеводороды и спирты. Вода, несмотря на то, что является полярным растворителем, также не диссоциирует на ионы.
Знание о процессе диссоциации на ионы позволяет лучше понять химические реакции, происходящие в растворах, и использовать это знание в практических целях. Например, распознавание диссоциативных и недиссоциативных веществ может помочь определить тип химической реакции или способность раствора проводить электрический ток. Кроме того, процессы диссоциации на ионы играют важную роль в области аналитической химии и исследовании растворимости веществ.
Факторы, влияющие на диссоциацию на ионы

На диссоциацию на ионы влияют следующие факторы:
| Фактор | Описание |
|---|---|
| Температура | Увеличение температуры обычно способствует увеличению диссоциации на ионы, что объясняется повышенной энергией молекул вещества. Однако есть исключения, например, диссоциация некоторых кислот снижается при повышении температуры. |
| Концентрация | Увеличение концентрации вещества в растворе обычно способствует увеличению диссоциации на ионы, так как увеличивается число столкновений молекул вещества. |
| Ионизирующая способность | Некоторые вещества обладают большей способностью диссоциировать на ионы, чем другие. Это зависит от их химического строения и свойств. |
| Давление | Давление обычно не оказывает существенного влияния на диссоциацию на ионы, за исключением некоторых реакций, где давление является важным фактором. |
| Растворитель | Растворитель может оказывать влияние на диссоциацию на ионы, так как может образовывать комплексы с веществами, что препятствует их диссоциации. |
В целом, диссоциация на ионы является сложным процессом, который может зависеть от различных факторов. Понимание этих факторов позволяет более точно предсказывать и объяснять поведение веществ в растворах.
Применение диссоциации на ионы

Химия
В химических реакциях диссоциация на ионы позволяет разделить соединения на ионы и улучшить их реакционную способность. Например, в процессе электролиза воды диссоциация на ионы гидроксидных ионов и водородных ионов позволяет получить водород и кислород. Этот процесс является важным в производстве водорода для использования в различных областях, таких как производство топлива.
Медицина
Диссоциация на ионы также играет важную роль в медицине. Например, в крови диссоциация на ионы кальция и фосфата помогает в поддержании костного здоровья и функций нервной системы. Диссоциация на ионы также используется в процессе диализа, где применяется перитонеальный диализ или гемодиализ для очистки крови от шлаков и отходов.
Промышленность
В промышленности диссоциация на ионы используется для различных целей, включая очистку воды, производство удобрений и пищевых добавок, а также в процессах гальванизации и электрохимического осаждения металлов. Например, в процессе очистки воды диссоциация на ионы помогает удалять загрязнения и соли из воды, делая ее безопасной для питья или использования в производственных целях.
| Примеры применения диссоциации на ионы |
|---|
| Производство водорода для использования в топливной промышленности |
| Поддержание костного здоровья и функций нервной системы в медицине |
| Очистка воды для питья и производственных целей |
| Производство удобрений и пищевых добавок |
| Гальванизация и электрохимическое осаждение металлов в промышленности |



