Квантовые числа – это основные параметры, которые используются для описания энергетических уровней и состояний атомов и молекул. Их определение и использование имеют важное значение в квантовой физике и химии. Квантовые числа позволяют нам предсказывать и объяснять поведение элементарных частиц и атомов, а также объединять различные атомы и молекулы в химические соединения.
Каждое квантовое число описывает определенный аспект квантовой системы, такой как энергия, форма, направление и вращение. Как правило, квантовые числа представляют собой целочисленные или полуцелочисленные значения, которые определяются из уравнений, основанных на принципах квантовой механики.
Примеры квантовых чисел включают основное квантовое число (n), орбитальное квантовое число (l), магнитное квантовое число (m) и спиновое квантовое число (s). Основное квантовое число определяет энергию и размер электронной орбитали, орбитальное квантовое число – форму и энергию орбитали, магнитное квантовое число – ориентацию орбитали в пространстве, а спиновое квантовое число – вращение электрона вокруг своей оси.
Что такое квантовые числа?
Квантовые числа включают четыре основных параметра: главное квантовое число (n), орбитальное квантовое число (l), магнитное квантовое число (m) и спиновое квантовое число (s).
Главное квантовое число (n) отражает энергетический уровень электрона в атоме и определяет его удаленность от ядра. Чем больше значение n, тем выше энергия электрона и дальше она находится от ядра. Главное квантовое число может принимать любое положительное целое число (1, 2, 3, и т.д.).
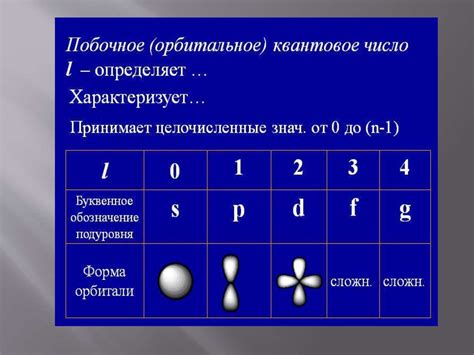
Орбитальное квантовое число (l) определяет форму орбитали электрона и указывает на ее момент импульса. Значение l зависит от значения n и может принимать значения от 0 до n-1. Например, при n=2 орбитальное квантовое число может быть 0 или 1.
Магнитное квантовое число (m) определяет ориентацию орбитали в пространстве и указывает на орбитальные подуровни в рамках каждой орбитали. Значение m зависит от значения l и может принимать значения от -l до +l. Например, при l=1 магнитное квантовое число может быть -1, 0 или 1.
Спиновое квантовое число (s) отражает вращение электрона вокруг своей оси и указывает на его спин. Значение s может быть +1/2 или -1/2.
Квантовые числа позволяют систематизировать электронные состояния и описывать их, а также предсказывать различные свойства атомов и молекул. Они являются фундаментальными понятиями в квантовой механике и являются ключевыми составляющими для понимания микромира и его законов.
Определение и основные характеристики

Всего существует четыре квантовых числа, каждое из которых имеет свою специальную функцию и характеристику:
Основное квантовое число (n) определяет главный энергетический уровень атома. Оно может принимать любое положительное целочисленное значение больше нуля. Чем больше значение основного квантового числа, тем выше энергетический уровень электрона.
Орбитальное квантовое число (l) описывает форму орбитали и определяет момент импульса электрона. Оно может принимать значения от 0 до (n-1). Например, для n=2 орбитальное квантовое число принимает значения 0 и 1.
Магнитное квантовое число (m) характеризует ориентацию орбитали в пространстве и определяет магнитный момент электрона. Оно может принимать значения от -l до +l. Например, для l=1 магнитное квантовое число принимает значения -1, 0 и 1.
Спиновое квантовое число (s) определяет направление вращения электрона и его спин. Оно может принимать только два значения: +1/2 и -1/2. Спиновое квантовое число играет важную роль в понимании структуры атомных и молекулярных систем.
Вместе все четыре квантовых числа идентифицируют конкретную электронную орбиталь и описывают ее основные свойства. Это позволяет ученым предсказывать и объяснять поведение атомных и молекулярных систем, а также проводить различные эксперименты в физике и химии.
Роль квантовых чисел в физике

Квантовые числа играют важную роль в физике, особенно в квантовой механике. Они помогают описать и предсказать поведение атомов и молекул, а также определить энергию электрона и его положение в атоме.
Основные квантовые числа - главное, орбитальное и магнитное, определяют разрешенные значения энергии, форму орбитали и ориентацию магнитного момента электрона в атоме. Главное квантовое число определяет энергетический уровень, на котором находится электрон. Орбитальное квантовое число определяет форму орбитали - s, p, d или f, а также количество подуровней. Магнитное квантовое число определяет ориентацию магнитного момента электрона относительно внешнего магнитного поля.
Значение квантовых чисел позволяет определить возможные состояния электронов в атоме, а также предсказать их переходы при поглощении или испускании энергии. Это помогает объяснить наблюдаемые спектры атомов и молекул, а также предсказывать их химические свойства.
Благодаря квантовым числам физики могут лучше понять строение вещества на микроскопическом уровне и разрабатывать новые материалы и технологии, учитывая их квантовые свойства. Это открывает новые возможности для развития физики и применения квантовой механики в различных сферах науки и техники.
Значение для атомной и квантовой физики

Первое квантовое число, главное квантовое число (n), отражает энергию и радиус орбиты электрона вокруг ядра атома. Большее значение этого числа соответствует более высокому энергетическому уровню и более удаленной орбите.
Второе квантовое число, орбитальное квантовое число (l), определяет форму орбитали электрона. Его значения могут быть целыми числами от 0 до n-1. Орбитальные квантовые числа помогают понять распределение электронов по подуровням энергии (s, p, d, f).
Третье квантовое число, магнитное квантовое число (ml), связано с ориентацией орбитали в пространстве. Значения этого числа могут варьироваться от -l до l, включая 0. Оно определяет число возможных ориентаций орбитали.
Наконец, четвертое квантовое число, спиновое квантовое число (ms), указывает на направление и величину спина электрона. Оно может быть либо +1/2, либо -1/2.
Значения квантовых чисел определяют поведение электронов в атомах и дают представление о спектральных линиях, допустимых энергетических состояниях и электронной конфигурации атомов. Понимание квантовых чисел позволяет исследовать и объяснять множество физических явлений на микроскопическом уровне.
В области атомной и квантовой физики квантовые числа являются важным инструментом для анализа и описания атомных систем. Они помогают представить структуру и электронную конфигурацию атомов, а также обусловливают спектральные свойства и взаимодействия атомов в химических реакциях и физических процессах.
Влияние на понимание структуры атома

Квантовые числа играют важную роль в физике и способствуют пониманию структуры атома. Они помогают определить основные характеристики электронных орбиталей и предсказывать поведение атомов и молекул.
Квантовые числа позволяют определить энергетический уровень электрона в атоме, его форму орбитали, магнитный момент, а также его спин. Они помогают объяснить, почему электроны занимают определенные орбитали и как они взаимодействуют друг с другом.
Одним из основных квантовых чисел является главное квантовое число (n), которое определяет энергетический уровень электрона и его расстояние от ядра. Соответствующие значения n могут быть любыми положительными целыми числами, начиная с 1.
Другим важным квантовым числом является орбитальное квантовое число (l), которое определяет форму орбитали и момент импульса электрона. Значения l могут быть целыми числами от 0 до (n-1).
Магнитное квантовое число (ml) определяет ориентацию орбитали в пространстве. Значения ml могут принимать любые целочисленные значения от -l до +l.
И, наконец, спиновое квантовое число (ms) определяет направление вращения электрона вокруг своей оси. Значение ms может быть +1/2 или -1/2.
Комбинации этих квантовых чисел позволяют описать полное состояние электрона в атоме и его поведение в электромагнитных полях, что также имеет большое значение для понимания и объяснения многочисленных физических явлений.
| Квантовое число | Определение | Диапазон значений |
|---|---|---|
| Главное квантовое число (n) | Энергетический уровень и расстояние от ядра | Натуральные числа, начиная с 1 |
| Орбитальное квантовое число (l) | Форма орбитали и момент импульса | Целые числа от 0 до (n-1) |
| Магнитное квантовое число (ml) | Ориентация орбитали в пространстве | Целые числа от -l до +l |
| Спиновое квантовое число (ms) | Направление вращения электрона | +1/2 или -1/2 |



