Равновесие – это основное понятие физики, которое применяется для описания состояний системы, когда ее параметры не изменяются со временем. Константа равновесия является важным показателем системы, поскольку она описывает ее стабильность и независимость от внешних условий.
Константа равновесия определяется как отношение скорости прямой реакции к скорости обратной реакции в равновесии. Она имеет постоянную величину для данной системы при определенных условиях (температуре, давлении, концентрации веществ и других параметрах) и не зависит от изменений этих условий.
Таким образом, константа равновесия позволяет нам предсказывать направление протекания химической реакции и выявлять условия, при которых система находится в равновесии. Знание константы равновесия важно для понимания многих аспектов химических процессов и разработки новых технологий.
Константа равновесия: понятие и суть

Константа равновесия выражается числом и зависит только от температуры. Исходное состояние системы и присутствие катализаторов не влияют на значение константы равновесия. Это означает, что независимо от внешних условий, таких как давление и концентрация, константа равновесия остается постоянной в определенных условиях температуры.
Значение константы равновесия позволяет определить направление реакции и состояние системы в равновесии. Если значение K больше единицы, реакция будет идти в сторону образования продуктов. Если K меньше единицы, реакция будет протекать в обратную сторону. Когда значение K равно единице, реакция находится в равновесии и концентрации реагентов и продуктов не изменяются со временем.
Применение константы равновесия в практике химических реакций позволяет предсказывать и контролировать процессы. Знание значения K позволяет оптимизировать условия реакции, чтобы достичь желаемого продукта и повысить выход конечного продукта.
Факторы, влияющие на константу равновесия

Одним из основных факторов, влияющих на константу равновесия, является температура. При повышении температуры обычно происходит смещение равновесия в сторону образования продуктов реакции. Однако это правило может не выполняться для некоторых реакций, где изменение температуры может вызывать обратное смещение равновесия.
Давление также может влиять на константу равновесия. При увеличении давления константа равновесия может измениться в зависимости от количества газовых компонентов в реакции. Увеличение давления может способствовать образованию большего количества газов или растворимых компонентов и, таким образом, повлиять на равновесие.
Концентрация веществ также является фактором, который может изменять константу равновесия. Увеличение концентрации реагентов обычно приводит к повышению константы равновесия, так как большее количество исходных реагентов может увеличить скорость обратной реакции.
Наличие катализаторов также может влиять на равновесие химической реакции. Катализаторы ускоряют скорость реакции, но не изменяют константу равновесия. Однако они могут повлиять на время достижения равновесия и скорость реакции в обе стороны.
Таким образом, факторы, влияющие на константу равновесия, включают температуру, давление, концентрацию веществ и присутствие катализаторов. Понимание этих факторов позволяет контролировать и оптимизировать процессы равновесия в химических реакциях.
Зависимость константы равновесия от температуры
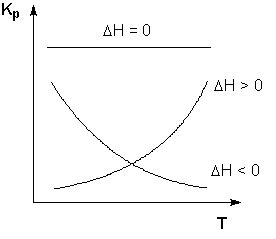
Однако, важно отметить, что константа равновесия не является постоянной величиной и может изменяться в зависимости от ряда факторов, включая температуру.
Известно, что при изменении температуры системы, скорость химической реакции может меняться. Также изменяется и константа равновесия. Это связано с тем, что влияние температуры на обратимые реакции проявляется через изменение энергии активации.
Так, при повышении температуры системы, энергия активации уменьшается, что приводит к увеличению скорости обратной реакции. В результате, константа равновесия уменьшается.
С другой стороны, при снижении температуры системы, энергия активации увеличивается, что приводит к увеличению скорости прямой реакции. Константа равновесия в данном случае увеличивается.
Влияние давления на константу равновесия
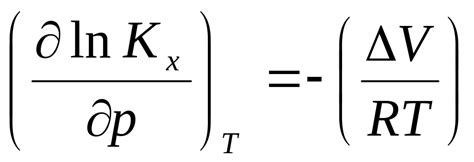
Согласно принципу Ле Шателье, изменение внешних условий, таких как давление, температура или концентрация, вызывает перемещение равновесной системы в направлении, которое компенсирует это изменение. Изменение давления может повлиять на равновесие, изменяя концентрацию реакционных компонентов.
При увеличении давления реакция смещается в сторону уменьшения молекул газа. В случае, если молекулы газа находятся в числителе уравнения реакции, увеличение давления будет приводить к увеличению константы равновесия. Напротив, если молекулы газа находятся в знаменателе уравнения реакции, увеличение давления будет приводить к уменьшению константы равновесия.
Однако, важно отметить, что влияние давления на константу равновесия зависит также от температуры. В случае эндотермической реакции, увеличение давления приведет к увеличению константы равновесия при низких температурах, но к уменьшению при высоких температурах. В случае экзотермической реакции, увеличение давления приведет к увеличению константы равновесия при высоких температурах, но к уменьшению при низких температурах.
Таким образом, влияние давления на константу равновесия является сложным и зависит от характера реакции и температуры. Понимание этих взаимосвязей позволяет предсказывать, как изменения давления влияют на константу равновесия и помогает управлять химическими процессами.
Взаимосвязь константы равновесия с концентрацией реагентов

Константа равновесия играет важную роль в химических реакциях, позволяя оценить, насколько полная или неполная реакция происходит. Эта величина не зависит от внешних условий, таких как температура, давление или объем системы.
Однако, константа равновесия зависит от концентрации реагентов, их отношения и скорости реакции. Каждый реагент, участвующий в химической реакции, вносит свой вклад в константу равновесия.
Если концентрация одного из реагентов увеличивается, то константа равновесия будет смещаться в сторону продуктов реакции, чтобы компенсировать этот эффект. Если концентрация реагентов уменьшается, то константа равновесия будет смещаться в сторону реагентов, чтобы увеличить концентрацию реагентов и достичь равновесия.
В случае, если один из реагентов полностью исчезает или его концентрация становится настолько мала, что его вклад в константу равновесия становится пренебрежимо малым, реакция считается практически завершенной и константа равновесия может быть считана постоянной.
Таким образом, константа равновесия является ключевой величиной, позволяющей определить, какие продукты реакции будут образовываться в большем количестве и насколько полная будет химическая реакция. Учитывая, что константа равновесия зависит от концентрации реагентов, можно контролировать и изменять направление химической реакции путем изменения концентрации реагентов, что широко используется в промышленности и лабораториях.
Ввод новых веществ и изменение константы равновесия

Константа равновесия (K) определяет, насколько полная реакция идет в прямом или обратном направлении. Однако, внешние условия могут оказывать влияние на эту константу, приводя к изменению равновесия.
Ввод новых веществ - это один из способов изменения равновесия. Добавление новых реагентов в систему может привести к смещению равновесия в сторону образования большего количества продуктов или реагентов, в зависимости от характера реакции и концентрации добавленных веществ.
Константа равновесия является зависимой величиной и может изменяться в зависимости от изменения температуры, давления или концентрации веществ в системе. Изменение концентрации реагентов или продуктов может вызвать изменение константы равновесия.
Например, если в систему добавить больше реагентов, концентрация продуктов увеличится, что приведет к увеличению значения константы равновесия. И наоборот, если в систему добавить продукты, константа равновесия уменьшится.
Также внешние условия, такие как температура и давление, могут оказывать влияние на константу равновесия. Изменение температуры может вызвать изменение соотношения между реактантами и продуктами, что повлияет на значение константы равновесия.
В целом, изменение константы равновесия под влиянием внешних условий может быть использовано для управления ходом химических реакций и увеличения выхода желаемых продуктов.
Практические применения константы равновесия

- Химическая промышленность: константа равновесия позволяет определить, в каком направлении протекает реакция, и использовать эту информацию для выбора оптимальных условий процесса. Например, зная значение константы равновесия, можно определить оптимальную температуру и давление для получения максимального выхода продукта.
- Фармацевтическая промышленность: константа равновесия играет важную роль в процессе разработки лекарственных препаратов. Она позволяет оценить, насколько эффективно препарат связывается с целевым белком или ферментом и определить оптимальные условия для получения максимальной активности препарата.
- Экология: константа равновесия используется для моделирования и анализа различных экологических процессов, таких как химические реакции в почвах или водоемах. Зная значение константы равновесия, можно прогнозировать, как изменится концентрация различных веществ при изменении условий окружающей среды.
- Исследования в области биохимии: константа равновесия широко применяется для изучения реакций, происходящих в живых организмах. Она позволяет оценить, какие факторы могут влиять на равновесие реакций, и определить механизмы их регуляции.
Таким образом, константа равновесия играет важную роль в различных областях науки и промышленности, помогая понять и контролировать химические процессы.



