Кислоты – это класс химических соединений, обладающих кислотными свойствами. Они играют важную роль в различных процессах, происходящих в живых организмах и окружающей среде. Кислоты широко применяются в промышленности, медицине, а также в повседневной жизни.
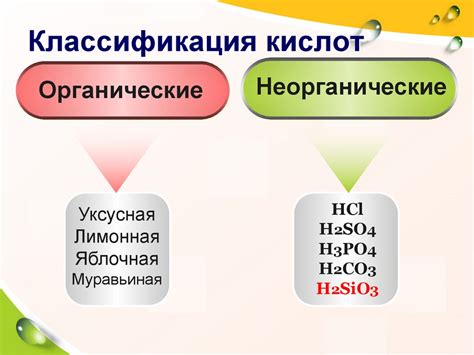
В зависимости от своего происхождения и свойств, кислоты делятся на несколько основных классов. Одним из наиболее распространенных видов кислот являются органические кислоты. Они образуются в живых организмах или могут быть синтезированы искусственным путем в лаборатории. Органические кислоты имеют сложную молекулярную структуру и обладают специфическими свойствами, которые варьируются в зависимости от их химического состава и функции.
Второй класс кислот – неорганические кислоты. Они образуются в результате реакции оксидов неметаллов с водой. Неорганические кислоты обладают сильными кислотными свойствами и используются для различных целей, включая очистку поверхностей и производство химических реактивов.
Кислоты выражаются различными физическими и химическими свойствами. Они обычно обладают кислотным вкусом, способны растворяться в воде и образовывать ионные растворы. Кроме того, кислоты обладают реактивностью и способностью образовывать соли с основаниями. Некоторые кислоты могут вызывать ожоги при контакте с кожей, поэтому при работе с ними необходимо соблюдать меры осторожности.
Определение и классификация кислот
Классификация кислот основывается на различных критериях, таких как их состав, строение и свойства. В зависимости от состава, кислоты могут быть бинарными (содержат два элемента) или оксокислотами (содержат кислород).
Бинарные кислоты состоят из водорода и другого элемента и имеют формулу HX, где X – химический символ второго элемента. Например, HCl (соляная кислота) и H2S (сероводородная кислота) – это бинарные кислоты.
Оксокислоты состоят из водорода, кислорода и другого элемента. Их формула может быть представлена как HnXmOn, где n – число атомов водорода, m – число атомов атомов другого элемента, а o – число кислородных атомов. Например, H2SO4 (серная кислота) и HNO3 (азотная кислота) – это оксокислоты.
| Вид кислоты | Состав | Примеры |
|---|---|---|
| Бинарные кислоты | HX | HCl, H2S |
| Оксокислоты | HnXmOn | H2SO4, HNO3 |
Физические свойства кислот

Кислоты обладают несколькими характеристиками, которые определяют их физические свойства.
Одним из основных физических свойств кислот является их кислотность. Кислотность кислот определяется их способностью отдавать протоны (H+) в растворе. Чем больше H+ ионов приходится на 1 литр раствора, тем кислее этот раствор. Кислотность кислот измеряется pH-шкалой, где значения ниже 7 указывают на кислотность.
Другим физическим свойством кислот является их способность взаимодействовать с металлами и образовывать с ними соли. Это свойство называется коррозионной активностью. Некоторые кислоты, такие как серная и азотная, могут реагировать с металлами, вызывая их окисление и образование солей.
Еще одним физическим свойством кислот является их способность оказывать раздражающее воздействие на ткани. Кислоты, такие как серная и соляная, могут вызывать ожоги при попадании на кожу или слизистую оболочку. Это связано с их высокой концентрацией и агрессивностью.
Большинство кислот обладают характерным запахом, который может быть слабым или резким. Например, серная кислота имеет интенсивный запах, в то время как лимонная кислота обладает слабым фруктовым ароматом.
Кислоты могут иметь разные виды агрегатных состояний. Некоторые кислоты, такие как соляная и азотная, являются жидкими при комнатной температуре. Другие кислоты, такие как серная и азотная, могут находиться в виде газов при нормальных условиях.
Химические свойства кислот

Основные химические свойства кислот включают:
| Свойство | Описание |
|---|---|
| Кислотные свойства | Кислоты реагируют с основаниями, образуя соль и воду. Эта реакция называется нейтрализацией. Например, кислота соляная (HCl) реагирует с гидроксидом натрия (NaOH), образуя соль - хлорид натрия (NaCl) и воду. |
| Коррозионные свойства | Некоторые кислоты могут вызывать коррозию металлов. Например, серная кислота (H2SO4) может разрушать металлы, такие как железо и алюминий. |
| Окислительные свойства | Некоторые кислоты способны окислять другие вещества. Например, азотная кислота (HNO3) является сильным окислителем и может окислить многие органические и неорганические соединения. |
| Электролитические свойства | Кислоты в растворе образуют ионно-молекулярные соединения и могут проводить электрический ток. Они являются электролитами. Например, уксусная кислота (CH3COOH) в водном растворе диссоциирует на ионы ацетата (C2H3O2-) и протона (H+). |
Эти свойства кислот делают их важными компонентами химических реакций и широко используемыми в различных отраслях промышленности и науке.
Применение кислот в промышленности и научных исследованиях
Кислоты играют важную роль в промышленных процессах и научных исследованиях благодаря своим уникальным свойствам и реакционной активности. Вот некоторые из областей, в которых кислоты находят широкое применение:
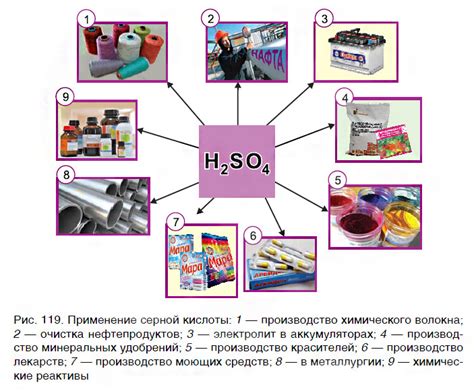
- Химическая промышленность: кислоты используются в процессах производства различных химических веществ, включая удобрения, пластик, красители, резины и другие продукты. Например, серная кислота широко используется в производстве удобрений и в процессах очистки воды.
- Металлургия: некоторые кислоты, такие как соляная кислота и азотная кислота, используются для обработки металлов, удаления окислов, очистки поверхностей и регулирования pH в процессе производства металлических изделий.
- Нефтегазовая промышленность: кислоты применяются в процессах очистки нефти и газа от примесей, а также для разрушения отложений и запуска новых скважин.
- Фармацевтическая промышленность: многие лекарственные препараты производятся с использованием кислотных реакций. Например, аскорбиновая кислота (витамин C) и ацетилсалициловая кислота (аспирин) являются широко используемыми препаратами в медицине.
- Аналитическая химия: кислоты применяются для определения концентрации и состава различных веществ, а также для настройки и калибровки лабораторной аппаратуры.
- Научные исследования: кислоты используются в различных научных исследованиях, включая синтез новых веществ, изучение химических реакций и исследование свойств материалов.
Все эти области демонстрируют значимость кислот как основных химических веществ, которые играют важную роль в различных сферах нашей жизни и обеспечивают функционирование различных промышленных и научных процессов.



