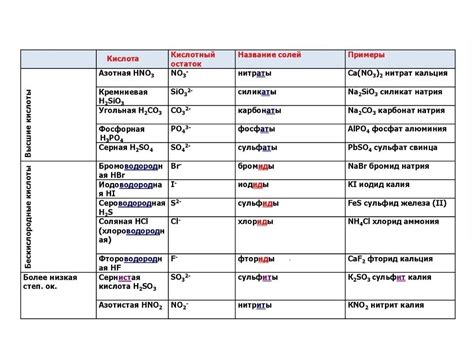
Кислотные остатки – это атомы и группы атомов, которые остаются после отщепления от кислоты одной или нескольких молекул воды. Они обладают отрицательным зарядом и вносят существенный вклад в химические свойства соответствующих кислот.
Каждый кислотный остаток имеет свое название, зависящее от кислоты, из которой он образуется. Например, когда мы отщепляем от серной кислоты (H2SO4) одну молекулу воды, получаем сернокислый остаток (SO42-).
Кислотные остатки играют важную роль в химических реакциях. Они могут образовывать соли, когда соединяются с основаниями. Кроме того, кислотные остатки определяют кислотность соединения. Любое вещество, содержащее кислотные остатки, является кислым соединением.
Кислотные остатки в химии 8: понятие и классификация
Кислотные остатки могут быть классифицированы на основе разных параметров, таких как химическая формула, строение и заряд. Одним из распространенных способов классификации кислотных остатков является деление их на неорганические и органические остатки.
Неорганические кислотные остатки обычно состоят из атомов металлов и кислорода. Они также могут включать другие элементы, такие как сера и фосфор. Примерами неорганических кислотных остатков являются сульфаты (SO42-), нитраты (NO3-) и фосфаты (PO43-).
Органические кислотные остатки содержат группы углерода и водорода в своей структуре. Они могут также содержать другие элементы, такие как кислород, азот и серу. Примерами органических кислотных остатков являются карбоксилаты (COO-), амины (NH2-) и фенилаты (C66-).
| Классификация | Примеры |
|---|---|
| Неорганические кислотные остатки | Сульфаты (SO42-), нитраты (NO3-), фосфаты (PO43-) |
| Органические кислотные остатки | Карбоксилаты (COO-), амины (NH2-), фенилаты (C66-) |
Понятие кислотных остатков в химии 8
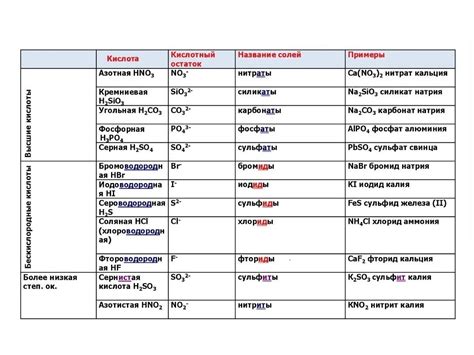
Восьмой класс программы по химии включает изучение множества важных концепций и терминов, включая понятие кислотных остатков. Кислотные остатки представляют собой частицы, образующиеся при диссоциации кислоты и могущие образовывать соли.
Кислоты содержат в своих молекулах одну или несколько групп кислородсодержащих атомов, называемых кислородсодержащими радикалами или кислотными остатками. Кислотные остатки играют важную роль в реакциях, связанных с кислотами и солями.
Кислотные остатки могут быть отрицательными или положительными, в зависимости от их заряда. Обычно, отрицательно заряженные кислотные остатки оканчиваются на "-ат", а положительно заряженные - на "-иев". Например, ушатовый остаток (-ат) и ушатовиевый остаток (-иев).
Знание о понятии кислотных остатков помогает понимать реакции и свойства кислот и солей, а также использовать их в практических применениях. Понимание принципов работы кислотных остатков является фундаментальным для дальнейшего изучения химии на более продвинутых уровнях.
</p>
Классификация кислотных остатков в химии 8
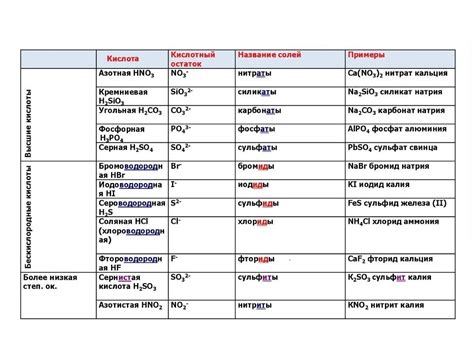
Кислотные остатки в химии 8 класса классифицируются по различным признакам, таким как состав, ионный заряд и характер связи с атомами в молекуле. Остатки могут быть одноатомными или многоатомными и иметь различный характер связи.
Одноатомные кислотные остатки обычно состоят из одного атома и являются отрицательно заряженными ионами. Примером такого остатка является гидроксидный ион (OH-). Остатки могут иметь положительный заряд, например, аммонийный ион (NH4+).
Многоатомные кислотные остатки состоят из нескольких атомов и могут иметь различные свойства ионов. Например, сульфатный остаток (SO4^2-) имеет отрицательный заряд и представляет собой соединение серы и кислорода. Карбонатный остаток (CO3^2-) также имеет отрицательный заряд и состоит из атомов углерода и кислорода.
Ионный заряд кислотного остатка определяется числом электронов, которые остатку требуется, чтобы достичь нейтрального состояния. Отрицательные заряды указывают на недостаток электронов, а положительные заряды указывают на избыток.
Кислотные остатки могут также быть классифицированы по характеру связи с атомами в молекуле. Остатки, которые удерживаются в молекуле при помощи ковалентных связей, называются ковалентными остатками. Они часто имеют большую стабильность и могут образовывать различные соединения.



