Взаимодействие основания с кислотой - это основной процесс химической реакции, при котором происходит образование соли. Основания и кислоты играют важную роль в химии, так как они могут реагировать между собой и образовывать разнообразные соединения.
Основание является химическим соединением, способным принимать протоны (водородные ионы) от кислоты. Основания обычно обладают специальными свойствами, такими как щелочность и горечь. Именно благодаря этим свойствам основания могут противостоять или нейтрализовать кислоты.
Кислоты же являются обратными соединениями, которые отдают свои протоны основаниям. Однако, кислоты и основания могут быть различными по своей силе. Некоторые кислоты и основания обладают большей активностью и способны полностью реагировать друг с другом, создавая соль и воду.
Таким образом, взаимодействие основания с кислотой является ключевым процессом в химии. Оно представляет собой химическую реакцию, при которой происходит образование соли и воды. Результат этой реакции зависит от свойств самих оснований и кислот, а также их концентрации и силы. При изучении химического взаимодействия оснований и кислот необходимо учитывать множество факторов, чтобы правильно описать происходящие процессы.
Химическая реакция между основанием и кислотой

Во время реакции основание принимает от кислоты протон (водородный ион H+) и образует свою собственную соль. Реакция нейтрализации характеризуется образованием ионов водорода из кислоты, ионов гидроксида из основания и ионов соли.
Обезоводненные соли, получающиеся в результате реакции нейтрализации, могут быть использованы в различных отраслях промышленности и в нашей повседневной жизни. Например, натриевая соль (NaCl) используется в пищевой промышленности для улучшения вкуса и сохранения продуктов. Кроме того, они могут использоваться в лечебных целях, например, для борьбы с избытком кислотности в желудке.
Химическая реакция между основанием и кислотой является фундаментальной в химии и имеет большое значение как в теоретических исследованиях, так и в практическом применении.
Основания и кислоты: взаимодействие и свойства
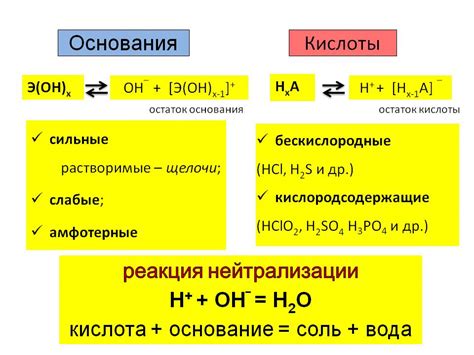
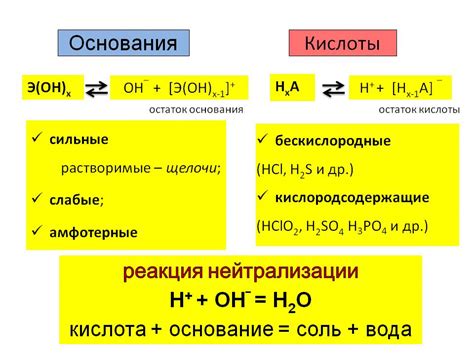
Основания обычно содержат в своей составе гидроксильную группу (-OH) или аминогруппу (-NH2). Примерами оснований являются гидроксид натрия (NaOH) и аммиак (NH3). Кислоты, в свою очередь, имеют в составе водород и кислород, а также другие элементы. Примерами кислот являются соляная кислота (HCl) и уксусная кислота (CH3COOH).
Взаимодействие оснований с кислотами происходит посредством протонного переноса. Основания принимают протон от кислоты, образуя соль и воду. Этот процесс называется нейтрализацией. Например, при взаимодействии гидроксида натрия (NaOH) и соляной кислоты (HCl) образуется хлорид натрия (NaCl) и вода (H2O).
Свойства оснований:
- У оснований есть вкус и запах, характерные для щелочей.
- Они обладают щелочной реакцией, то есть изменяют красный лакмус на синий и показывают показатель рH больше 7.
- Они растворяются в воде, образуя гидроксиды.
- Они имеют способность нейтрализовать кислоты.
Свойства кислот:
- Кислоты имеют кислотный вкус и запах.
- Они могут изменить синий лакмус на красный и показывают показатель рH меньше 7.
- Они растворяются в воде, образуя ионизированные водородные ионы (H+).
- Они имеют способность нейтрализоваться основаниями.
Взаимодействие оснований с кислотами является фундаментальным процессом в химии и применяется практически во всех сферах науки и технологий, включая производство лекарств, пищевую промышленность и синтез новых материалов.
Амфотерность: основание и кислота одновременно
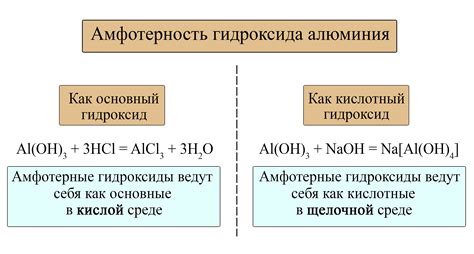
Взаимодействие между основанием и кислотой обычно протекает так, что основание принимает протон от кислоты, образуя соль. Однако существуют вещества, которые могут выступать и как основание, и как кислота одновременно. Такое свойство называется амфотерностью.
Амфотерные вещества могут взаимодействовать не только с кислотой, но и с основанием, образуя две разные соли.
Примером такого вещества является вода (H2O). Вода имеет способность как принимать протоны от кислоты, так и отдавать протоны основанию. В результате этого взаимодействия образуется двойная соль.
| Кислота | Основание | Образованная соль |
|---|---|---|
| H2SO4 (серная кислота) | H2O (вода) | H3O+ (гидроксидный катион) |
| HCl (хлороводородная кислота) | H2O (вода) | [H3O]+ (гидроксидный катион) |
Таким образом, амфотерность позволяет некоторым веществам проявлять свойства и основания, и кислоты, что является важным в химических реакциях и образовании солей.
Реакция с образованием соли

Одним из примеров реакции с образованием соли является реакция нейтрализации, при которой водный раствор кислоты смешивается с раствором основания:
- Происходит образование воды и соли.
- Катионы основания сочетаются с анионами кислоты, образуя соль.
- Водные молекулы выполняют роль реагента, который присоединяется к значительной части катионов и анионов.
- В результате образуется раствор с солью и водой.
Реакция с образованием соли является важной химической реакцией и имеет множество применений. Соли широко используются в пищевой промышленности, медицине, сельском хозяйстве и других отраслях.
Механизм реакции между основанием и кислотой
Когда основание и кислота встречаются, ионы H+ из кислоты переходят к основанию, образуя воду. В свою очередь, ионы OH- из основания переходят к кислоте, образуя соль. Таким образом, происходит обмен ионами между основанием и кислотой, что приводит к образованию соли и воды.
Важно отметить, что механизм реакции между основанием и кислотой может быть разным в зависимости от конкретных веществ и условий реакции. Некоторые основания и кислоты могут реагировать быстро и эффективно, а другие могут требовать специфических условий, таких, как определенная температура или присутствие катализатора.
Также стоит отметить, что при реакции между основанием и кислотой может образовываться не только одна соль, но и дополнительные продукты, такие как газы или осаждение. Это может зависеть от конкретных веществ и условий реакции.
Химический баланс и стехиометрия в реакции

Химический баланс в реакции указывает на соотношение между реагентами и продуктами. Он показывает, сколько молекул каждого вещества участвует в реакции и каким образом они связаны друг с другом. Балансировка уравнений позволяет соблюсти закон сохранения массы – масса реагентов равна массе продуктов.
Стехиометрия в реакции определяет, в каких пропорциях осуществляется взаимодействие между реагентами. Она позволяет определить точное соотношение между их массами, объемами или количествами веществ.
Химический баланс и стехиометрия в реакции позволяют определить количество реагентов, необходимых для получения определенного количества продукта. Это важно для планирования и проведения химических процессов, а также для оценки эффективности реакции.
Пример: Рассмотрим реакцию между соляной кислотой (HCl) и гидроксидом натрия (NaOH) с образованием соли хлорида натрия (NaCl) и воды (H2O). Химическое уравнение для этой реакции выглядит следующим образом:
2HCl + 2NaOH → 2NaCl + H2O
В данном случае химический баланс показывает, что для полного осуществления реакции требуется две молекулы соляной кислоты и две молекулы гидроксида натрия. Стехиометрия указывает, что каждая молекула соляной кислоты взаимодействует с одной молекулой гидроксида натрия, образуя две молекулы соли хлорида натрия и одну молекулу воды.
Таким образом, понимание химического баланса и стехиометрии позволяет правильно предсказывать и описывать реакции взаимодействия оснований с кислотами и образования солей.
Примеры реакций основания с кислотой
| Основание | Кислота | Соль | Вода | Уравнение реакции |
|---|---|---|---|---|
| Гидроксид натрия (NaOH) | Соляная кислота (HCl) | Хлорид натрия (NaCl) | Вода (H2O) | NaOH + HCl → NaCl + H2O |
| Гидроксид калия (KOH) | Серная кислота (H2SO4) | Сульфат калия (K2SO4) | Вода (H2O) | KOH + H2SO4 → K2SO4 + H2O |
| Гидроксид аммония (NH4OH) | Азотная кислота (HNO3) | Нитрат аммония (NH4NO3) | Вода (H2O) | NH4OH + HNO3 → NH4NO3 + H2O |
Эти примеры демонстрируют различные реакции основания с кислотой и образование соответствующих солей. Знание этих реакций помогает понять процессы, происходящие при взаимодействии различных соединений.



