Окисление, как известно, является химическим процессом, в результате которого атом теряет или передает электроны. Во время окисления атом становится положительно заряженным и называется положительным ионом. Конечно, не все атомы неметаллов способны окисляться одинаково и иметь одну и ту же высшую степень окисления. В этой статье мы рассмотрим различные неметаллы и определим, какая их высшая степень окисления.
Одним из самых известных неметаллов является кислород. У кислорода высшая степень окисления равна -2. Это означает, что кислород может принимать от других элементов до двух электронов. Например, в молекуле воды (H2O) каждый атом кислорода принимает по два электрона от атомов водорода, чтобы достичь своей стабильной октиэтовой конфигурации.
Еще одним важным неметаллом является хлор. У хлора высшая степень окисления также равна -1. В хлоридных соединениях, например в хлористом натрии и хлориде кальция, каждый атом хлора принимает один электрон от другого элемента или атома. Таким образом, хлор ищет возможность получить одно электронное октетное состояние, чтобы достичь стабильности.
Конечно, есть и другие неметаллы, каждый из которых имеет свою высшую степень окисления. Изучение высших степеней окисления неметаллов позволяет нам более глубоко понять химические свойства их соединений. Знание высших степеней окисления также очень полезно при проведении различных химических реакций и в создании новых соединений.
Что такое окисление

Окисление является важным понятием в химии, так как позволяет классифицировать вещества по их способности окислять или восстанавливать другие вещества. В реакциях окисления одно вещество, называемое окислителем, принимает электроны от другого вещества, которое называется восстановителем.
Существует также понятие степени окисления, которое отражает число электронов, потерянных или полученных атомом вещества при окислительно-восстановительной реакции. Степень окисления помогает определить характер взаимодействия веществ и позволяет установить высшую степень окисления неметаллов.
| Вещество | Высшая степень окисления |
|---|---|
| Кислород (O) | +2 |
| Фтор (F) | -1 |
| Хлор (Cl) | -1 |
| Бром (Br) | -1 |
| Иод (I) | -1 |
| Азот (N) | +5 |
| Углерод (C) | +4 |
| Сера (S) | +6 |
| Фосфор (P) | +5 |
Знание высшей степени окисления неметаллов позволяет лучше понять и прогнозировать их реакционную способность и способствует более глубокому изучению закономерностей химических процессов.
Высшая степень окисления у неметаллов и их химические свойства

Высшая степень окисления представляет собой наибольшее положительное значение, которое неметалл может принять в химической реакции. Это важная характеристика, определяющая химические свойства неметаллов.
У неметаллов высшая степень окисления обычно равна значению их электроотрицательности. Например, у кислорода (электроотрицательностью 3,5) высшая степень окисления равна +2, а у фтора (электроотрицательностью 4,0) - +1.
Неметаллы обладают разнообразными химическими свойствами, такими как высокая электроотрицательность, низкая теплопроводность, хорошая изоляция и т.д. Они могут образовывать соединения с различными элементами, включая другие неметаллы и металлы. Большинство неметаллов являются более активными в химических реакциях по сравнению с металлами.
Высшая степень окисления неметаллов может быть использована для определения их активности в химических реакциях. Чем выше степень окисления, тем более активными они являются. Некоторые неметаллы проявляют амфотерные свойства, то есть они могут образовывать как оксиды кислотного характера, так и оксиды основного характера.
Неметаллами являются многие вещества, которые находят широкое применение в различных областях, включая биологию, электронику, медицину и т.д. Изучение и понимание их высшей степени окисления и химических свойств помогает в развитии новых материалов и технологий.
Список неметаллов и их высшие степени окисления
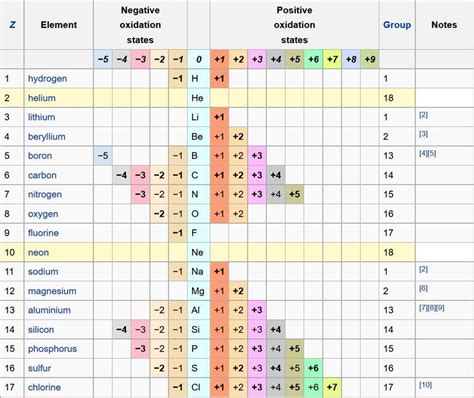
Ниже приведен список неметаллов и их высших степеней окисления:
| Неметалл | Высшая степень окисления |
|---|---|
| Кислород (O) | +2 |
| Фтор (F) | -1 |
| Хлор (Cl) | +7 |
| Бром (Br) | +7 |
| Иод (I) | +7 |
| Азот (N) | +5 |
| Фосфор (P) | +5 |
| Сера (S) | +6 |
Это лишь некоторые примеры неметаллов и их высших степеней окисления. Степени окисления могут меняться в зависимости от конкретных условий и соединений, в которых участвуют эти элементы.
Что влияет на высшую степень окисления у неметаллов

Высшая степень окисления у неметаллов определяется различными факторами, включая электроотрицательность, атомный радиус и электронную конфигурацию.
Электроотрицательность играет важную роль в определении высшей степени окисления неметалла. Электроотрицательность - это способность атома атома атома атома атома атома атома атома атома атома атома атома атома атома атома атома атома атома атома атома атома атома атома атома такому межмолекулярному соединению, являются ли они нор мор г более электроотрицательные соседи. Чем выше электроотрицательность, тем больше вероятность окисления атома.
Атомный радиус также влияет на высшую степень окисления у неметаллов. Чем меньше атомный радиус, тем больше вероятность окисления атома. Это связано с тем, что меньший атомный радиус обеспечивает большую привлекательную силу на электроны, что делает их более склонными к окислению.
Электронная конфигурация также влияет на высшую степень окисления неметаллов. Некоторые элементы имеют специфические электронные конфигурации, которые делают их особенно склонными к окислению. Например, хлор имеет электронную конфигурацию 2s^2 2p^6 3s^2 3p^5, что делает его склонным к получению одного электрона для достижения октета и образования иона Cl^-.
| Неметалл | Высшая степень окисления |
|---|---|
| Кислород | +2 |
| Хлор | +7, -1 |
| Фосфор | +5, -3 |
| Сера | +6, -2 |
Значение высшей степени окисления в химических реакциях

Высшая степень окисления неметаллов имеет важное значение при проведении химических реакций. Она указывает на наибольшую возможную потерю электронов неметаллом при образовании химических связей.
Знание высшей степени окисления неметалла позволяет идентифицировать окислитель в химической реакции, а также предсказать направление протекающих процессов.
У каждого неметалла есть определенное значение высшей степени окисления, которое устанавливается на основе таблицы высших степеней окисления элементов. Например, у хлора (Cl) высшая степень окисления равна -1, у кислорода (O) -2, у серы (S) +6 и т. д.
Значение высшей степени окисления может меняться в зависимости от условий реакции и окружающей среды. Например, у серы степень окисления может быть как +4, так и +6. Это связано с тем, что сера может образовывать соединения с различными элементами и изменять степень окисления в этих соединениях.
Знание высшей степени окисления неметаллов помогает определить тип химической реакции. Например, реакция между оксидами неметаллов и водой является реакцией окисления-восстановления и может проходить по следующему сценарию:
- Неметалл окисляется, теряя электроны, и его степень окисления увеличивается.
- Вода восстанавливается, получая электроны, и её степень окисления уменьшается.
Таким образом, значение высшей степени окисления неметаллов важно для понимания и предсказания результата химических реакций и может быть использовано при проведении различных химических процессов.
Как определить высшую степень окисления у неметаллов

Высшая степень окисления у неметаллов можно определить, исходя из их положения в периодической системе элементов и заряда, с которым они образуют соединения.
Периодическая система элементов отражает упорядоченное расположение элементов по возрастанию атомного номера и дает представление о строении и свойствах химических элементов.
Высшая степень окисления неметаллов определяется как наибольшее положительное значение заряда, с которым неметалл может образовывать соединения. Обычно, для определения высшей степени окисления у неметаллов используются следующие правила:
- Кислород, как электроотрицательный элемент, обычно имеет степень окисления -2.
- Водород в соединении с неметаллами обычно имеет степень окисления +1.
- Степень окисления халогенов (флуор, хлор, бром, йод), как правило, составляет -1.
- Степень окисления неметаллов, не входящих в основные группы, может быть различной и зависит от конкретной молекулы или иона, с которым они образуют соединение. Для определения степени окисления этих элементов следует воспользоваться таблицами окислительно-восстановительных свойств соединений или таблицами степеней окисления.
Определение высшей степени окисления у неметаллов позволяет понять, какие типы соединений и какие реакции могут происходить с данным элементом. Это важно при изучении химических свойств и взаимодействий неметаллов в химических процессах.
Примеры соединений и их высшая степень окисления
Неметаллы могут образовывать различные соединения с другими элементами. Высшая степень окисления неметалла указывает на максимальное количество электронов, которые он может потерять или разделить при образовании соединения.
Вот несколько примеров соединений неметаллов и их высшей степени окисления:
- Кислород (O) - высшая степень окисления +2.
- Фтор (F) - высшая степень окисления +1.
- Хлор (Cl) - высшая степень окисления +7.
- Бром (Br) - высшая степень окисления +5.
- Йод (I) - высшая степень окисления +7.
- Азот (N) - высшая степень окисления +5.
- Фосфор (P) - высшая степень окисления +5.
- Сера (S) - высшая степень окисления +6.
Эти примеры демонстрируют разнообразие высшей степени окисления у различных неметаллов. Она может быть положительной или отрицательной величиной, что указывает на их разную способность принимать или отдавать электроны при образовании химических соединений.



