Определение концентрации раствора является важным этапом в химическом анализе. Один из самых распространенных способов определения концентрации раствора - это использование pH-метра. pH-метр измеряет уровень кислотности или щелочности в растворе, что позволяет определить его концентрацию.
Для определения концентрации раствора через pH следует знать pH-зависимость конкретного вещества. Каждое вещество имеет определенное значение pH при определенной концентрации. Эта зависимость можно найти в специальных справочниках или в литературе по химии.
Определение концентрации раствора при помощи pH-метра может быть полезным в различных областях, включая медицину, пищевую промышленность и научные исследования. Точные измерения pH позволяют контролировать качество продуктов и обеспечивать безопасность пациентов.
Определение концентрации раствора через pH

Для определения концентрации раствора через pH необходимо знать показатель pH и последующим образом использовать уравнения реакции для конкретного вещества.
- Для кислот:
- Используйте уравнение реакции, где кислота диссоциирует и образует H+ и анион. Запишите соотношение концентраций H+ и аниона.
- Используя известное значение pH, определите концентрацию H+.
- После определения концентрации H+, используйте уравнение реакции для нахождения концентрации кислоты.
- Для щелочей:
- Используйте уравнение реакции, где щелочь образует OH- и катион. Запишите соотношение концентраций OH- и катиона.
- Используя известное значение pH, определите концентрацию OH-.
- После определения концентрации OH-, используйте уравнение реакции для нахождения концентрации щелочи.
Определение концентрации раствора через pH может быть полезным при анализе химических растворов и позволяет получить информацию о концентрации кислоты или щелочи без необходимости проведения сложных химических экспериментов.
Что такое pH и как его измерять

Измерение pH производится с помощью специальных приборов - pH-метров. Они представляют собой электроды, которые регистрируют разницу потенциалов между раствором и их внутренним референтным электродом. Результат измерения отображается на цифровом дисплее pH-метра.
Для проведения измерения необходимо поместить pH-электрод в раствор, который нужно измерить, и дождаться стабилизации показаний на дисплее. Затем можно записать значение pH и использовать его для определения концентрации раствора с помощью соответствующих таблиц или формул.
Важно помнить, что pH-метр должен быть калиброван перед каждым измерением с использованием стандартных буферных растворов с известным pH. Это позволяет установить точность и надежность измерений.
Влияние концентрации на pH раствора
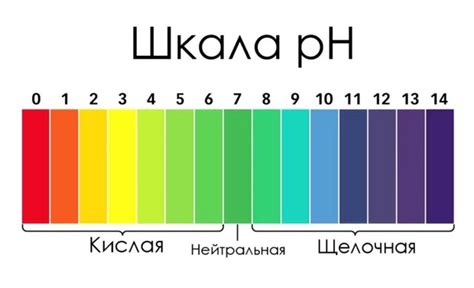
Концентрация раствора имеет значительное влияние на его pH. pH раствора определяется концентрацией ионов водорода (H+) в растворе. Чем больше ионов H+ содержится в растворе, тем ниже его pH.
При увеличении концентрации раствора происходит увеличение количества ионов H+. Это приводит к уменьшению pH раствора. Величина изменения pH зависит от концентрации раствора и может быть описана с помощью численной зависимости.
В таблице приведены примеры значений pH при различных концентрациях раствора:
| Концентрация раствора | pH |
|---|---|
| Высокая концентрация | Низкий pH |
| Средняя концентрация | Средний pH |
| Низкая концентрация | Высокий pH |
Таким образом, при измерении pH раствора необходимо учитывать его концентрацию. Изменение концентрации может привести к существенным изменениям в pH, что важно учитывать при проведении химических исследований и контроле качества растворов.
Таблица соответствия pH и концентрации

Для определения концентрации раствора через pH необходимо знать соответствие между этими двумя параметрами. Для удобства использования мы представляем таблицу с соответствием pH и концентрации, которая поможет вам провести необходимые расчеты.
| pH | Концентрация |
|---|---|
| 0 | 1 моль/л |
| 1 | 0.1 моль/л |
| 2 | 0.01 моль/л |
| 3 | 0.001 моль/л |
| 4 | 0.0001 моль/л |
| 5 | 0.00001 моль/л |
| 6 | 0.000001 моль/л |
| 7 | 0.0000001 моль/л |
| 8 | 0.00000001 моль/л |
| 9 | 0.000000001 моль/л |
| 10 | 0.0000000001 моль/л |
Это лишь примеры соответствия pH и концентрации для различных значений. Значение pH может принимать любое число от 0 до 14, а концентрация может иметь другие значения в зависимости от раствора, соединения или вещества, с которым вы работаете.
Методы определения концентрации через pH
| Метод | Принцип |
|---|---|
| Титрование | Определение концентрации известного реагента, который реагирует с исследуемым раствором до достижения эквивалентной точки. |
| Измерение потенциала ион-селективного электрода | Использование электрода, чувствительного к определенным ионам, для измерения их концентрации и рассчета pH. |
| Использование индикаторов | Изменение цвета индикатора в зависимости от pH раствора позволяет определить его концентрацию. |
Каждый из этих методов имеет свои преимущества и ограничения, и выбор метода зависит от конкретной ситуации и требуемой точности определения концентрации раствора.
Применение определения концентрации через pH в лаборатории
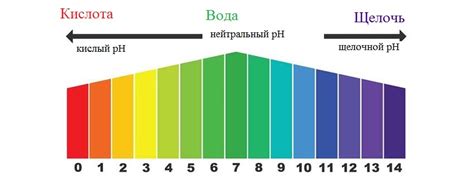
Применение определения концентрации через pH позволяет исследовать широкий спектр веществ, к примеру, кислоты, щелочи или соли. В лаборатории это особенно полезно, так как позволяет более точно контролировать и измерять концентрацию растворов, что может быть важно для определения их применимости в различных процессах или реакциях.
Определение концентрации через pH является непосредственным методом измерения и наиболее точным, поскольку основано на прямых измерениях и расчетах. Этот метод также является относительно быстрым и простым, что делает его привлекательным для использования в лаборатории.
Важно учитывать, что определение концентрации через pH возможно только в случае, если мы знаем зависимость pH от концентрации раствора. Для этого требуется проведение заранее известных измерений и построение калибровочной кривой. После этого можно использовать полученные данные для определения концентрации неизвестного раствора.
В итоге, применение определения концентрации через pH в лаборатории позволяет измерять и контролировать концентрацию растворов с высокой точностью, что может быть полезным при проведении различных экспериментов и исследований.
Применение определения концентрации через pH в промышленности
Применение определения концентрации через pH находит свое применение во многих сферах, включая химическую, пищевую, фармацевтическую, нефтехимическую и многие другие отрасли.
Например, в химической промышленности определение концентрации через pH используется для контроля концентрации кислот и щелочей. Этот метод позволяет оперативно регулировать концентрацию требуемого раствора и поддерживать стабильность процессов.
В пищевой промышленности определение концентрации через pH применяется для контроля кислотности и свежести продуктов. Это позволяет поддерживать оптимальные условия и качество продукции.
В фармацевтической промышленности определение концентрации через pH используется для качественного контроля лекарственных препаратов. Это помогает обеспечивать соответствие высокому стандарту качества и эффективности препаратов.
Использование определения концентрации через pH в промышленности помогает сократить затраты на анализ и обеспечивает точные и надежные результаты.
| Отрасль промышленности | Применение определения концентрации через pH |
|---|---|
| Химическая | Контроль концентрации кислот и щелочей |
| Пищевая | Контроль кислотности и свежести продуктов |
| Фармацевтическая | Контроль качества лекарственных препаратов |
| Нефтехимическая | Контроль концентрации различных растворов |
Таким образом, определение концентрации через pH является важным методом в промышленности, который позволяет контролировать и поддерживать оптимальные условия процессов и качество продукции.
Ограничения и осложнения при определении концентрации через pH

1. Ионизация воды: При определении концентрации раствора через pH необходимо учитывать ионизацию воды. Ионизация воды может изменяться в разных условиях раствора и может приводить к искажению результатов.
2. Температурная зависимость: Концентрация раствора через pH может зависеть от температуры. При изменении температуры водного раствора изменяется и ионизация воды, что влияет на pH и может вызывать погрешность при определении концентрации.
3. Влияние других ионов: Присутствие других ионов в растворе может влиять на концентрацию ионов водорода и гидроксид-ионов, а следовательно, на pH. Это может стать причиной неточности при определении концентрации раствора через pH.
4. Точность измерения pH: Определение pH с высокой точностью требует использования точного и калиброванного pH-метра с учетом его чувствительности и особенностей измерений. Погрешности измерений могут привести к неточности определения концентрации раствора через pH.
5. Неконстантный коэффициент ионизации: Зависимость коэффициента ионизации от концентрации может меняться в зависимости от раствора и условий эксперимента. Это может привести к неточным результатам и трудностям при определении концентрации через pH.
6. Химические реакции: В растворе могут происходить химические реакции, которые могут изменить концентрацию ионов и их взаимодействие, что в свою очередь может повлиять на pH и усложнить определение концентрации раствора.
7. Метрологические проблемы: Для точного определения концентрации раствора через pH необходимо проводить калибровку и контроль pH-метра, использовать стандартные растворы и соблюдать правила и методики измерений. Нарушение данных требований может привести к неточным результатам и осложнениям при определении концентрации через pH.
- Концентрацию раствора можно определить через измерение его pH.
- Для определения концентрации раствора через pH необходимо знать соответствующий кислотно-основной индикатор и его свойства.
- Изменение pH раствора может быть использовано для определения концентрации кислоты или основания в нем.
- Расчет концентрации раствора через pH основан на химическом равновесии между кислотой и основанием.
- Важно учитывать температуру и другие факторы, которые могут влиять на показания pH-метра и точность определения концентрации раствора.
Использование pH для определения концентрации раствора является одним из методов анализа, который может быть полезен в химических и биологических исследованиях, а также в промышленности.