Масса атома – это один из основных параметров, используемых в физике для описания микромирной структуры вещества. Измерение массы атома играет ключевую роль в определении его химических свойств и поведения в химических реакциях. В данной статье мы рассмотрим основные методы измерения массы атома и современные приборы, используемые в этом процессе.
Первые попытки измерить массу атома были предприняты в начале XIX века. Ученые экспериментировали с различными методами, включая химические реакции и измерение объемов газов. Однако, только в начале XX века их усилия были вознаграждены, когда были открыты радиоактивные элементы и предложена новая концепция измерения массы атома.
Радиоактивные элементы оказались полезными в измерении массы атома, потому что они имеют нестабильные ядра, которые распадаются со временем, испуская радиацию и меняя свои химические свойства. Ученые использовали эту свойственную им нестабильность для создания системы относительных масс элементов.
Масса атома: определение и значение

Массу атома обычно измеряют в атомных единицах массы (а. е. м.). Одна атомная единица массы определяется как 1/12 массы атома углерода-12.
Определение массы атома включает в себя различные методы, такие как масс-спектрометрия, изотопный анализ и изучение атомной структуры. Стоит отметить, что масса атома не является постоянной величиной и может различаться в зависимости от изотопов элемента.
Значение массы атома играет важную роль в различных сферах науки и техники, включая физику, химию, материаловедение и ядерную энергетику. Она позволяет определить молекулярные и атомные массы соединений, прогнозировать физические свойства веществ и производить расчёты при реакциях и превращениях элементов.
Таким образом, знание массы атома основополагающе для понимания микромира и макромира и является ключом к развитию науки и технологий.
История открытия методов измерения массы атома

Вопрос о массе атома стоял перед учеными уже с давних времен. Однако, измерение массы атома оказалось непростой задачей, требующей разработки специальных методов и инструментов.
Первое приближенное измерение относительной массы атома было сделано Джоном Далтоном в 1803 году. Он предположил, что атомы различных элементов имеют разную массу, и предложил относительные массы атомов в сравнении с атомом водорода. Однако, эти данные были грубыми оценками и не могли быть считаны точными.
В 20-х годах прошлого века французский физик Альберт Эйнштейн предложил теорию относительности, которая имела прямое отношение к измерению массы атома. Согласно его теории, масса и энергия взаимосвязаны, а энергия может быть преобразована в массу и наоборот. Эта теория имела важное значение для развития методов измерения массы атома.
В 1932 году Джеймс Чедвик открыл метод регистрации энергетических освобождений при бомбардировке атомов плотными электронными пучками. Он использовал этот метод для измерения массы протона, нейтрона и электрона.
В 1940 году физики Альфред Отто и Фридрих Адольф Панец изобрели метод масс-спектрометрии, который позволяет точно измерять массу атомов и молекул. Этот метод стал ключевым для измерения массы атомов.
С тех пор методы измерения массы атома продолжают совершенствоваться, и современные инструменты позволяют измерять массу с высокой точностью.
Точность и современные методы измерения массы атома

Одним из основных методов измерения массы атома является метод масс-спектрометрии. Этот метод основан на принципе разделения ионов по их относительной массе. Ионы атомов проходят через магнитное поле, где они отклоняются под действием силы Лоренца. Зная угол отклонения ионов и силу магнитного поля, можно определить отношение массы атома к заряду ионов. Далее, с помощью других экспериментов, можно получить точное значение массы атома.
Современные методы измерения массы атома включают использование суперпроводников, сверхпроводимых магнитов и высокочастотных масс-спектрометров. Эти методы позволяют достичь невероятно высокой точности измерений, на уровне 10-12 г.
Кроме того, для определения массы атома используются такие методы, как методы радиоактивного распада, методы лазерной спектроскопии и методы масс-спектрометрии с использованием ионных ловушек и магнитных уловителей.
| Метод | Точность измерения |
|---|---|
| Масс-спектрометрия | 10-12 г |
| Радиоактивный распад | 10-8 г |
| Лазерная спектроскопия | 10-10 г |
| Ионные ловушки | 10-11 г |
| Магнитные уловители | 10-12 г |
Современные методы измерения массы атома позволяют достичь высокой точности и подтверждают верность основных законов физики. Они являются основой для дальнейших исследований и разработок в области физики элементарных частиц и материаловедения.
Методы взаимодействия атомов в физическом эксперименте
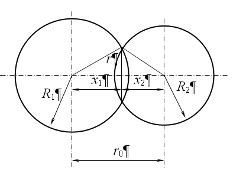
В физических экспериментах для измерения массы атома используются различные методы взаимодействия атомов. Они позволяют установить массу атома, определить его строение и свойства.
Одним из методов взаимодействия атомов является масс-спектрометрия. В этом методе атомы ионы атомов проходят через магнитное поле, которое отклоняет их в зависимости от их массы и заряда. Масс-спектрометр регистрирует отклонение и определяет массу атома по этим данным. Такой метод позволяет измерить массу атома с высокой точностью.
Еще одним методом взаимодействия атомов является ядерное магнитное резонансное исследование (ЯМР). В ЯМР-спектроскопии атомы помещают в магнитное поле и подвергают облучению радиочастотным излучением. Атомы, взаимодействуя с излучением, испытывают резонансное поглощение энергии, что позволяет определить их массу и структуру. ЯМР является очень точным методом определения массы атома.
Также в физическом эксперименте используется метод масс-спектрометрии с использованием электронного улавливания. Атомы, обладающие отрицательным зарядом, попадают в электронную ловушку, где они сталкиваются с электронами и образуют ионы. Затем ионы попадают в масс-спектрометр, где их массу можно определить.
Таким образом, существует несколько методов взаимодействия атомов в физическом эксперименте, которые позволяют определить массу атома с высокой точностью. Эти методы играют важную роль в изучении атомной структуры и свойств атомов.
Два основных метода измерения массы атома

В физике существует несколько методов измерения массы атома. В данной статье рассмотрим два основных метода измерения, которые широко применяются в научных исследованиях.
Первый метод - спектрометрия. Он основан на анализе спектра электромагнитного излучения, испускаемого атомами. Путем измерения смещения или расщепления линий спектра можно определить массу атома. Для этого используются приборы, называемые спектрометрами. Данный метод достаточно точен, но требует сложных и дорогостоящих установок.
Второй метод - использование масс-спектрометров. Масс-спектрометрия основана на разделении ионов по их отношению масса-заряд. Атомы анализируемого вещества ионизируются, затем разделение происходит в магнитном поле, где ионы двигаются по криволинейной траектории. Измеряя радиусы или радиусы кривизны траекторий ионов, можно рассчитать массу атома. Масс-спектрометрия является более точным и мощным методом, чем спектрометрия. Кроме того, масс-спектрометры обладают высокой чувствительностью и позволяют анализировать идентифицировать отдельные атомы и молекулы.
Оба этих метода являются важными инструментами в физике и химии. Они позволяют определить массу атома с высокой точностью и являются основой для многих научных исследований.
Зависимость массы атома от состава ядра и электрона
Масса ядра определяется суммой масс протонов и нейтронов, входящих в его состав. Протоны имеют положительный заряд, а нейтроны являются нейтральными частицами. Масса протона примерно равна массе нейтрона и составляет примерно 1,67 × 10^(-27) килограмма.
Масса электрона на порядок меньше массы протона и нейтрона и составляет примерно 9,11 × 10^(-31) килограмма. Таким образом, масса электрона практически не оказывает влияния на общую массу атома.
Однако, масса ядра и электрона не являются постоянными значениями и могут различаться в различных элементах. Атом различных элементов отличается своим атомным числом, которое определяет количество протонов в ядре. С учетом этого, масса атома может изменяться в зависимости от элемента.
Изменения массы атома от состава ядра и электрона проявляются в явлении изотопии. Изотопы – это различные версии атома одного и того же элемента, отличающиеся массовым числом. Изотопы содержат одинаковое количество протонов, но отличаются количеством нейтронов в ядре. В результате, масса ядра может быть различной для разных изотопов, и, следовательно, масса атома также будет отличаться.
| Элемент | Символ | Масса ядра (кг) |
|---|---|---|
| Углерод | C | 1,993 × 10^(-26) |
| Кислород | O | 2,657 × 10^(-26) |
| Азот | N | 2,325 × 10^(-26) |
Приведенная выше таблица демонстрирует различие в массе ядра для трех разных элементов – углерода, кислорода и азота. Масса ядра каждого элемента была измерена и выражена в килограммах. Это подтверждает факт, что масса атома зависит от состава его ядра и электрона.
Роль массы атома в физике и применение в науке
Масса атома используется в различных научных исследованиях и экспериментах. Например, в химии масса атома используется для расчета молекулярных масс и проведения реакций. Она является основой для расчета стехиометрических соотношений и определения количества вещества, участвующего в химической реакции.
В физике масса атома играет важную роль при изучении ядерных реакций и ядерной физики. Масса атома определяет его ядро и влияет на свойства элемента и вещества в целом. Также, масса атома используется при расчетах энергетических характеристик, например, при проведении экспериментов по ядерной фиссии или синтезу новых элементов.
Масса атома также имеет важное значение в астрономии и космологии. Определение массы атомов позволяет изучать звезды, галактики и другие объекты Вселенной. Используя данные о массе атомов, ученые могут провести расчеты и моделирование, позволяющее более точно описать и понять процессы, происходящие в космосе.
Таким образом, масса атома играет важную роль в физике и науке в целом. Она является основным параметром, определяющим свойства и характеристики атомов, и используется во многих научных исследованиях и экспериментах.



