Сжатие газа - это процесс изменения объема и плотности газовой среды путем уменьшения межмолекулярного расстояния. В результате сжатия газа молекулы начинают взаимодействовать между собой с большей силой и частотой, вызывая изменение их свойств и состояния.
Одним из основных принципов изменения молекул при сжатии газа является увеличение внутренней энергии системы. В результате, молекулы газа приобретают большую скорость движения и сталкиваются друг с другом все чаще. Это приводит к увеличению числа столкновений и повышению средней энергии столкновений, что, в свою очередь, приводит к повышению температуры газовой среды.
Важным аспектом изменения молекул при сжатии газа является изменение их объема. По мере сжатия газа, объем, занимаемый молекулами, уменьшается, что приводит к увеличению его плотности. Молекулы начинают располагаться ближе друг к другу, что влияет на их взаимодействие и свойства. Помимо изменения объема и плотности газа, сжатие также приводит к изменению его давления и вязкости.
Фазовые переходы в газе
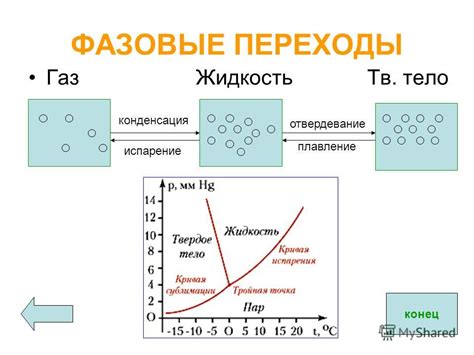
Один из наиболее известных фазовых переходов в газе - это конденсация. Когда газ охлаждается или подвергается повышению давления, часть его молекул теряет тепловую энергию и начинает замедляться, образуя жидкость. Это явление можно наблюдать, например, когда влажный пар конденсируется на стекле в виде капель.
Обратным процессом является испарение - переход из жидкого состояния в газообразное. При нагревании или уменьшении давления жидкость начинает испаряться, и ее молекулы приобретают достаточно энергии, чтобы преодолеть силы притяжения и перейти в газовую фазу.
В некоторых случаях газ может претерпевать сублимацию - прямой переход из твердого состояния в газообразное без образования жидкости. Примером такого фазового перехода может служить сублимация сухого льда - твердого углекислого газа, который при снижении давления прямо переходит в газовую фазу.
Важным фактором при фазовых переходах в газе является состояние среды - температура и давление. Они оказывают существенное влияние на скорость и направление фазовых переходов.
Фазовые переходы в газе имеют большое значение в различных процессах и явлениях, таких как атмосферные осадки, погодные явления и промышленные процессы. Понимание этих процессов и их влияния на окружающую среду позволяет более эффективно управлять ими и использовать их в наших целях.
Принципы изменения молекул

При сжатии газа происходят изменения в молекулах этого газа, которые определяют его поведение и свойства. В процессе сжатия газа молекулы становятся ближе друг к другу, что приводит к изменению их взаимодействий.
Одним из основных принципов изменения молекул при сжатии газа является увеличение частоты столкновений между молекулами. При сжатии газа объем, в котором находятся молекулы, уменьшается, что приводит к увеличению среднего расстояния между молекулами. Более близкое расположение молекул увеличивает вероятность их столкновений, что приводит к повышению частоты столкновений и количества энергии, переносимой при столкновениях.
Другой принцип изменения молекул при сжатии газа связан с увеличением давления. При сжатии газа сила, действующая на поверхность молекул, увеличивается. Это приводит к увеличению давления газа. Увеличение давления влечет за собой изменение взаимодействия молекул и усиление влияния сил притяжения между ними.
Третьим принципом изменения молекул при сжатии газа является увеличение плотности. Плотность газа определяется количеством молекул, находящихся в единице объема. При сжатии газа количество молекул в объеме увеличивается, что приводит к увеличению плотности. Более высокая плотность газа влияет на его физические и химические свойства, такие как вязкость, теплопроводность и растворимость.
Изменение молекул при сжатии газа является фундаментальным процессом, который приводит к изменению поведения и свойств газа. Понимание принципов изменения молекул при сжатии газа позволяет более точно предсказывать и контролировать результаты сжатия газа и применять его в различных технологических процессах и приборах.
Процессы сжатия газа
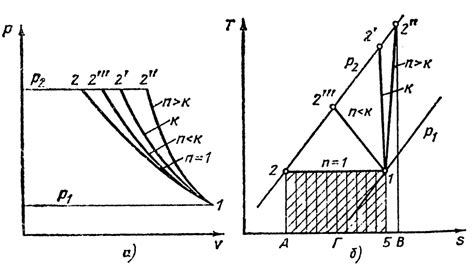
Адиабатическое сжатие – это процесс сжатия газа, при котором изменение тепловой энергии идет исключительно за счет изменения давления. Во время адиабатического сжатия газ не обменивается теплом с окружающей средой, поэтому его температура повышается. Адиабатическое сжатие широко применяется в промышленности, например, для сжатия воздуха в компрессорах.
Изотермическое сжатие – это процесс сжатия газа, при котором его температура остается постоянной. При изотермическом сжатии газ обменивается теплом с окружающей средой таким образом, чтобы его температура не изменялась. Изотермическое сжатие используется, например, в газовых турбинах и холодильных установках.
Изобарическое сжатие – это процесс сжатия газа при постоянном давлении. Во время изобарического сжатия объем газа уменьшается, но его давление остается неизменным. Изобарическое сжатие широко применяется в промышленности, например, для сжатия газов в цилиндрах или баллонах.
Изохорическое сжатие – это процесс сжатия газа при постоянном объеме. Во время изохорического сжатия давление газа повышается, но его объем остается неизменным. Изохорическое сжатие может быть полезным при проведении экспериментов или в лабораторных условиях.
Выбор процесса сжатия газа зависит от конкретных требований и задач, которые необходимо решить. Каждый из этих процессов имеет свои преимущества и ограничения, и правильный выбор поможет достичь оптимальных результатов.
Химические реакции при сжатии газа

Сжатие газа происходит под воздействием давления, которое позволяет заметно уменьшить объем газа. Этот процесс может привести к различным химическим реакциям внутри газовой смеси.
Сжатие газа часто сопровождается увеличением концентрации молекул в объеме, что может способствовать увеличению вероятности столкновений между молекулами. Это, в свою очередь, может привести к активации химических реакций.
При сжатии газа могут происходить следующие химические реакции:
1. Реакции взаимодействия газов с твердыми веществами: при сжатии газов, таких как кислород или азот, с твердыми веществами, например, металлами, может возникать окисление или реакция образования соединений. Например, при сжатии кислорода с металлом могут образовываться оксиды металла.
2. Реакции газовых компонентов между собой: при сжатии газовой смеси, содержащей различные компоненты, молекулы газов могут активно сталкиваться и реагировать друг с другом. Например, при сжатии смеси кислорода и водорода может происходить реакция образования воды.
3. Фотохимические реакции: сжатие газа может создавать условия для фотохимических реакций, при которых световая энергия используется для активации молекул и реализации химических реакций. Например, при сжатии газа может происходить фотохимическое окисление озона.
Сжатие газа может быть полезным для исследования и управления химическими реакциями. Оно может увеличивать скорость реакции, способствовать образованию новых соединений или изменению структуры газа. Поэтому изучение изменения молекул при сжатии газа является важной областью физико-химических исследований.
Обратите внимание, что при сжатии газа также требуется учет влияния физических факторов, таких как температура и давление, на процессы химических реакций. Эти факторы могут влиять на скорость и направление реакций при сжатии.
Экзотермические реакции

В результате этого в реакции между молекулами газа может происходить выделение тепла. Такие реакции часто используются в промышленности, например, при производстве взрывчатых веществ или в качестве источников энергии.
Для примера можно рассмотреть реакцию сгорания газа. При этом происходит реакция между молекулами кислорода и газа, и выделяется большое количество тепла. Получившееся тепло можно использовать для привода двигателей или в качестве источника энергии для других процессов.
Другим примером экзотермической реакции является окисление металлов воздухом при повышенной температуре и давлении. В этом случае также происходит выделение тепла, которое может быть использовано для получения энергии.
Экзотермические реакции имеют большое значение в различных отраслях промышленности и науке. Изучение этих реакций позволяет разрабатывать новые способы производства энергии и материалов, а также оптимизировать уже существующие процессы.
Химическое равновесие
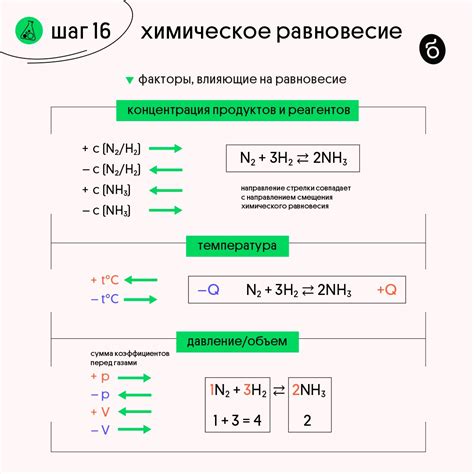
Химическое равновесие достигается при определенных условиях, таких как определенная температура и давление. Когда система находится в равновесии, происходят микроскопические изменения в молекулярном уровне, где некоторые молекулы продолжают претерпевать реакцию, но скорости прямой и обратной реакций остаются постоянными.
Химическое равновесие имеет важное значение во многих аспектах химии и физики. Оно позволяет предсказать, какие реакции будут протекать и в каком направлении. Знание химического равновесия также позволяет оптимизировать условия реакции и управлять концентрациями веществ в системе.
Химическое равновесие может быть изменено изменением концентрации веществ, температуры или давления. Принцип Ле Шателье утверждает, что если на систему в равновесии воздействуют внешние факторы, система будет смещаться в направлении, противоположном воздействию.
Примером химического равновесия может служить реакция образования аммиака из азота и водорода:
N2(g) + 3H2(g) ⇌ 2NH3(g)
При исходных условиях температуры и давления, система будет достигать химического равновесия, где скорости образования и распада аммиака будут равны. Изменение концентрации азота, водорода или аммиака в системе сместит равновесие реакции в определенном направлении.



