Идеальный газ - это модель газа, в которой предполагается, что между его молекулами нет взаимодействия, а объем каждой молекулы неизмеримо мал по сравнению с объемом газа. Также предполагается, что молекулы газа движутся в случайном порядке и со случайными скоростями.
Идеальный газ обладает несколькими важными свойствами. Во-первых, его давление прямо пропорционально количеству молекул газа и их средней кинетической энергии. Во-вторых, объем идеального газа снижается с увеличением давления, и наоборот. В-третьих, температура идеального газа прямо пропорциональна средней кинетической энергии его молекул.
Реальный газ, в отличие от идеального, обладает определенными взаимодействиями между его молекулами. Такие взаимодействия могут проявляться в виде притяжения или отталкивания между молекулами. Эти взаимодействия имеют важное значение при высоких давлениях и низких температурах, когда объем молекул газа становится сравнимым с объемом газа в целом.
Реальные газы также могут обладать свойством конденсации, при котором они переходят из газообразного состояния в жидкое или твердое. Это происходит при достижении определенной температуры, называемой точкой конденсации. Также реальные газы могут образовывать облака или пены, что является следствием конденсации влаги в воздухе.
Различия между идеальным газом и реальным газом

Молекулярная структура
Одно из главных различий между идеальным газом и реальным газом заключается в структуре и взаимодействии его молекул. Идеальный газ считается состоящим из отдельных молекул, которые не взаимодействуют друг с другом и с окружающей средой. В то же время, у реального газа есть сложная молекулярная структура, и его молекулы взаимодействуют друг с другом посредством различных сил, в том числе сил притяжения и отталкивания.
Уравнение состояния
Для идеального газа существует идеальное газовое уравнение состояния, которое позволяет определить его характеристики, такие как давление, объем и температура. Оно имеет вид: PV = nRT, где P - давление газа, V - его объем, n - количество вещества, R - универсальная газовая постоянная, T - температура. В отличие от этого, реальный газ не всегда подчиняется условиям идеальности, поэтому требуется использовать более сложные уравнения состояния для его описания.
Сжимаемость
Идеальный газ считается полностью сжимаемым, так как его молекулы не обладают объемом. В то же время, реальный газ обладает определенным объемом, и его сжатие может вызвать изменение в его свойствах и поведении.
Реальные условия
Идеальный газ существует только в идеализированной форме и не может быть полностью достигнут в реальных условиях. Реальный газ, напротив, существует в обычных условиях окружающей среды и находится под влиянием различных факторов, таких как давление, температура и объем. Поэтому, при работе с реальными газами, необходимо учитывать эти факторы и корректировать их влияние на его свойства.
- Идеальный газ:
- Состоит из отдельных невзаимодействующих молекул.
- Подчиняется идеальному газовому уравнению состояния.
- Полностью сжимаем.
- Существует только в идеализированной форме.
- Реальный газ:
- Имеет сложную молекулярную структуру и взаимодействует с другими молекулами.
- Требует использования более сложных уравнений состояния для описания своих характеристик.
- Обладает определенным объемом и может быть сжат.
- Существует в обычных условиях и находится под влиянием различных факторов.
Характеристики идеального газа

1. Молекулярная структура: Идеальный газ представляет собой совокупность частиц, которые считаются точечными и не имеют объема. Каждая частица в идеальном газе движется независимо от других частиц и сталкивается с ними только при соударении.
2. Упругие столкновения: Столкновения между частицами идеального газа считаются упругими, то есть при столкновении сохраняется полный импульс и полная кинетическая энергия системы. Это приводит к тому, что частицы идеального газа не теряют энергию при столкновениях.
4. Закон Шарля: В соответствии с законом Шарля, объем идеального газа прямо пропорционален его температуре при постоянном давлении. Это означает, что при повышении температуры, объем идеального газа увеличивается, а при понижении температуры – уменьшается.
5. Закон Гей-Люссака: Закон Гей-Люссака связывает давление идеального газа с его температурой при постоянном объеме. Согласно этому закону, давление идеального газа прямо пропорционально его температуре.
6. Идеальность: В реальности не существует газа, который полностью соответствовал бы идеальному газу. Однако, при определенных условиях (низкое давление, высокая температура), некоторые реальные газы показывают поведение, близкое к поведению идеального газа.
Характеристики реального газа

Реальный газ отличается от идеального газа некоторыми характеристиками, которые важны при его изучении и применении в различных областях науки и техники. Ниже приведены некоторые из них:
| Характеристика | Описание |
|---|---|
| Взаимодействия частиц газа | В отличие от идеального газа, реальные газы испытывают взаимодействия между своими частицами. Эти взаимодействия влияют на их движение и свойства газа в целом. |
| Уравнение состояния | Для описания поведения реальных газов используются более сложные уравнения состояния, например, уравнение Ван-дер-Ваальса или уравнение Дирихле–Эйлера. Эти уравнения учитывают взаимодействия между частицами и позволяют более точно описать свойства газа. |
| Коэффициент сжимаемости | Реальные газы обладают коэффициентом сжимаемости, который характеризует их способность изменять свой объем под воздействием давления. Идеальный газ имеет коэффициент сжимаемости равный нулю, в то время как реальные газы имеют ненулевое значение этого коэффициента. |
| Фазовые переходы | Реальные газы могут испытывать фазовые переходы, такие как конденсация и испарение. При определенных условиях температуры и давления газ может конденсироваться в жидкость или твердое состояние, а наоборот, жидкость или твердое вещество могут перейти в газообразное состояние. |
| Реальные уравнения состояния | Существует ряд уравнений состояния для реальных газов, которые учитывают их специфические свойства. К ним относятся уравнение Клапейрона-Менделеева, уравнение Редлиха-Куанга и другие. Эти уравнения позволяют более точно описывать поведение реальных газов в различных условиях. |
Изучение и понимание этих характеристик реальных газов позволяет более точно моделировать их поведение и использовать эти знания в различных областях науки и техники, таких как химическая промышленность, физика, аэродинамика и другие.
Поведение идеального газа при изменении давления и объема
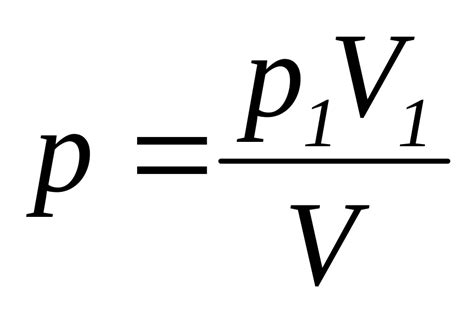
Согласно закону Бойля-Мариотта, при постоянной температуре объем идеального газа обратно пропорционален его давлению. Это означает, что при увеличении давления, объем газа уменьшается, а при уменьшении давления, объем газа увеличивается. Это соотношение можно выразить следующей формулой:
P1 * V1 = P2 * V2
где P1 и V1 - изначальное давление и объем газа, а P2 и V2 - новое давление и объем газа после изменения условий.
Однако, следует отметить, что закон Бойля-Мариотта справедлив только при постоянной температуре и при отсутствии других внешних факторов, таких как реакции или изменение количества вещества.
Идеальный газ также следует закону Гей-Люссака, который устанавливает прямую пропорциональность между давлением и температурой газа при постоянном объеме. Это означает, что при увеличении давления, температура газа также увеличивается, а при уменьшении давления, температура газа уменьшается. Формула, описывающая этот закон, выглядит следующим образом:
P1 / T1 = P2 / T2
где P1 и T1 - изначальное давление и температура газа, а P2 и T2 - новое давление и температура газа после изменения условий.
Кроме того, идеальный газ также подчиняется уравнению состояния идеального газа - уравнениям Клапейрона. Это уравнение устанавливает зависимость между давлением, объемом, температурой и количеством вещества идеального газа. Формула уравнения Клапейрона:
P * V = n * R * T
где P - давление газа, V - его объем, n - количество вещества газа (в молях), R - универсальная газовая постоянная, T - температура газа.
Идеальный газ не обладает силами взаимодействия молекул, что делает его поведение при изменении давления и объема относительно простым и предсказуемым. Однако, в реальных условиях существуют реальные газы, которые отклоняются от идеального поведения и подчиняются дополнительным законам и уравнениям.
| Закон | Математическая формула | Физическое уравнение |
|---|---|---|
| Закон Бойля-Мариотта | P1 * V1 = P2 * V2 | Газ при постоянной температуре изменяет свой объем пропорционально изменению давления |
| Закон Гей-Люссака | P1 / T1 = P2 / T2 | Газ при постоянном объеме изменяет свою температуру пропорционально изменению давления |
| Уравнение Клапейрона | P * V = n * R * T | Установлена зависимость между давлением, объемом, температурой и количеством вещества газа |
Поведение реального газа при изменении давления и объема
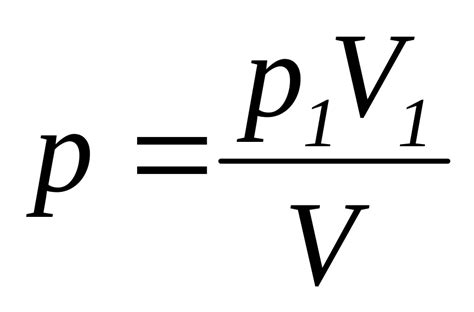
Реальные газы обладают некоторыми отличительными свойствами от идеальных газов. Когда давление или объем реального газа изменяются, происходят различные явления, которые не наблюдаются в идеальных газах.
При увеличении давления на реальный газ, его объем сжимается, но нелинейно. В идеальном газе объем пропорционален обратно давлению (закон Бойля-Мариотта), однако, в реальных газах существуют межмолекулярные взаимодействия, которые влияют на их поведение. Эти взаимодействия приводят к тому, что реальные газы сжимаются менее сильно, чем идеальные газы при одном и том же изменении давления.
Кроме того, при изменении объема реального газа происходит изменение его давления. В идеальном газе изменение объема не влияет на давление (закон Бойля-Мариотта), но в реальных газах происходят коллизии и взаимодействия между молекулами. При уменьшении объема реального газа коллизии между молекулами увеличиваются, что приводит к увеличению давления.
Суммируя, можно сказать, что реальные газы проявляют неидеальное поведение при изменении давления и объема. Их сжатие и расширение не подчиняются закону Бойля-Мариотта, а происходят в результате сложных взаимодействий между молекулами. Понимание этого неидеального поведения реальных газов является важным для ряда научных и промышленных приложений, таких как проектирование газовых систем и расчеты в области химической технологии.
| Давление | Объем |
|---|---|
| Увеличение | Сжатие газа |
| Уменьшение | Расширение газа |
Взаимодействие между частицами идеального газа
Взаимодействие между частицами реального газа происходит через различные силы, такие как ван-дер-ваальсовы силы притяжения и отталкивания, электростатические силы и др. Эти силы вызывают изменение объема и давления газа и влияют на его физические свойства.
В идеальном газе считается, что частицы не взаимодействуют друг с другом, а сталкиваются только со стенками сосуда, в котором находятся. Поэтому идеальный газ подчиняется уравнению состояния, известному как уравнение Ван-дер-Ваальса.
Однако, в реальности, взаимодействие между частицами может вызывать дополнительные эффекты, такие как конденсация или ионизация газа. Эти эффекты могут привести к изменениям физических свойств газа, таких как его теплопроводность и электропроводность.
Взаимодействие между частицами реального газа также может вызывать эффекты, связанные с образованием молекулярного строения газа, такие как возникновение связей между частицами или образование кластеров. Эти эффекты существенно влияют на свойства газа и его поведение при различных условиях.
- Взаимодействие между частицами реального газа может вызывать изменение их скорости и траектории. Это может привести к образованию турбулентности или диффузии газа.
- Взаимодействие между частицами реального газа также может вызывать изменение их энергии, что влияет на их кинетическую, потенциальную и внутреннюю энергию.
- Взаимодействие между частицами реального газа может приводить к образованию химических соединений и реакций, что вносит изменения в состав и свойства газа.
В целом, взаимодействие между частицами реального газа играет важную роль в определении его свойств и поведения. Понимание этих взаимодействий помогает нам лучше понять физические и химические свойства газов и применять их в различных областях науки и техники.
Взаимодействие между частицами реального газа
Реальный газ состоит из частиц, которые взаимодействуют друг с другом. В отличие от идеального газа, взаимодействие между частицами в реальном газе играет существенную роль и влияет на его свойства.
Взаимодействие между частицами реального газа может проявляться в различных формах. Одной из них является кулоновское взаимодействие, основанное на электростатическом притяжении или отталкивании зарядов. Это взаимодействие проявляется в газах, состоящих из заряженных частиц, таких как ионы или электроны. Кулоновское взаимодействие способно изменять свойства реального газа, такие как его электрическая проводимость или электрическое сопротивление.
Другим видом взаимодействия между частицами реального газа является физическое взаимодействие. Взаимодействие в этой форме может основываться на силе притяжения, силе отталкивания или других физических процессах, таких как столкновения. Физическое взаимодействие между частицами в реальном газе может приводить к изменению энергии, импульса и других характеристик газа.
Кроме того, между частицами реального газа может происходить химическое взаимодействие. Химическое взаимодействие является результатом реакций между атомами или молекулами газа. Такие реакции могут приводить к образованию новых веществ или изменению структуры частиц газа.
Взаимодействие между частицами реального газа влияет на такие свойства газа, как давление, температура, объем и плотность. Однако, взаимодействие между частицами может быть сложным для описания и требовать использования сложных математических моделей. Поэтому, в отличие от идеального газа, реальный газ требует более сложного подхода для его описания и анализа.



