Группа А в таблице Менделеева образует одну из наиболее интересных и важных групп химических элементов. Всего в этой группе находится 8 элементов, начиная с элемента гелия и заканчивая элементом неона. Они являются самыми легкими элементами в периодической системе и имеют ряд уникальных химических свойств.
Группа А включает в себя элементы, которые обладают высокой химической активностью. Гелий, например, является одним из самых инертных элементов, не образующих химических соединений. Неон также обладает похожими свойствами. Однако, элементы группы А могут формировать различные соединения с другими элементами. Они могут реагировать с элементами, принадлежащими к группам В и Г, образуя химические соединения.
Самым важным элементом в группе А является гелий. Он широко используется в научных и промышленных целях, включая заправку аэростатов и ракетных двигателей. Гелий также является невероятно важным для современной медицины, где его используют в виде газа для дыхания и для создания различных медицинских процедур.
Неон, находящийся в этой же группе, используется в световых вывесках, газонасосах, лазерах и других электронных устройствах. Этот элемент хорошо известен своей яркостью и прекрасно подходит для создания ярких и цветных иллюминаций.
Первичные атомы группы A: литий, натрий, калий
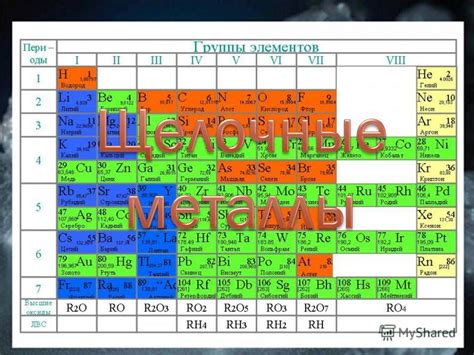
Литий (Li) - самый легкий металл из всех химических элементов. Он обладает низкой плотностью и низкой температурой плавления. Литий сильно реагирует с водой и образует гидроксид лития и водород. Литий используется в аккумуляторах, стекле и производстве лекарственных препаратов.
Натрий (Na) - серебристо-белый мягкий металл. Он также реагирует с водой, образуя гидроксид натрия и водород. Натрий широко используется в промышленности, особенно в производстве стекла, мыла и пищевых добавок.
Калий (K) - серебристо-белый металл, похожий на натрий. Калий также активно реагирует с водой и образует гидроксид калия и водород. Калий используется в производстве удобрений, стекла и мыла, а также в медицине.
Химические свойства группы А элементов
Группа А в таблице Менделеева, также известная как группа щелочных металлов, представлена элементами первой группы: литием (Li), натрием (Na), калием (K), рубидием (Rb), цезием (Cs) и францием (Fr). Все эти элементы обладают общими химическими свойствами, которые делают их чрезвычайно активными и химически реактивными.
Основные химические свойства группы А элементов включают:
| Свойство | Описание |
|---|---|
| Активность | Группа А элементов является наиболее активной группой в периодической системе. Они легко реагируют с водой, кислородом, галогенами и другими веществами, образуя соединения. |
| Металлические свойства | Все элементы группы А являются металлами. Они обладают характерными металлическими свойствами, такими как блеск, деформируемость и теплопроводность. |
| Электрохимическая активность | Элементы группы А являются сильными восстановителями и легко окисляются, образуя положительные ионы со зарядом +1. |
| Реакция с водой | Элементы группы А активно реагируют с водой, образуя щелочные гидроксиды и высвобождая водород. Реакция с водой происходит более интенсивно с увеличением атомного номера элемента. |
| Образование солей | Группа А элементов образует щелочные соли с кислотами, обладая сильными щелочными свойствами. Соли щелочных металлов широко используются в различных областях, таких как пищевая промышленность и медицина. |
Химические свойства группы А элементов делают их неотъемлемой частью нашей повседневной жизни. Они являются одними из основных компонентов веществ, которые мы используем ежедневно, таких как щёлочные батарейки, соли, моющие средства и многое другое.
Высокая реактивность металлов группы А
Металлы группы А Менделеева имеют высокую реактивность, что связано с их внешней электронной структурой. У этих элементов на внешнем энергетическом уровне находится один или два электрона, что делает их склонными к химическим реакциям.
Металлы первой группы, такие как литий (Li), натрий (Na) и калий (K), обладают высокой реактивностью из-за того, что у них на внешнем энергетическом уровне находится один электрон. Этот электрон легко отдается в реакциях с другими веществами, образуя положительные ионы. Например, литий может реагировать с водой, образуя гидроксид лития и водород.
Металлы второй группы, такие как бериллий (Be), магний (Mg) и кальций (Ca), имеют два электрона на внешнем энергетическом уровне. Эти металлы также обладают высокой реактивностью и образуют положительные ионы. Например, магний может реагировать с кислородом, образуя оксид магния.
Высокая реактивность металлов группы А делает их полезными во множестве химических реакций и применений. Они могут быть использованы в процессе синтеза различных соединений, а также в производстве батарей, сплавов и металлических конструкций.
Реакция с водой: образование гидроксидов

В группе А находятся такие элементы, как натрий (Na), калий (K), литий (Li), рубидий (Rb), цезий (Cs) и франций (Fr). При взаимодействии с водой, эти элементы образуют соответствующие гидроксиды. Например, натрий при реакции с водой образует гидроксид натрия (NaOH), а калий – гидроксид калия (KOH).
Реакция между элементами группы А и водой является экзотермической, то есть сопровождается выделением тепла. В результате реакции образуются гидроксиды и выделяется водород. Гидроксиды обладают щелочными свойствами и могут использоваться в различных процессах и химических реакциях.
| Элемент | Гидроксид |
|---|---|
| Натрий | Гидроксид натрия (NaOH) |
| Калий | Гидроксид калия (KOH) |
| Литий | Гидроксид лития (LiOH) |
| Рубидий | Гидроксид рубидия (RbOH) |
| Цезий | Гидроксид цезия (CsOH) |
| Франций | Гидроксид франция (FrOH) |
Гидроксиды, образованные при реакции элементов группы А с водой, являются важными соединениями для различных отраслей промышленности и науки. Они используются в химическом синтезе, производстве щелочей, электролитов для аккумуляторов и других сферах.
Схожие химические свойства металлов группы А

Металлы группы А в таблице Менделеева, также известные как щелочные металлы, имеют сходные химические свойства. Они включают литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr).
Одно из наиболее заметных свойств щелочных металлов - их реакция с водой. Все металлы группы А активно реагируют с водой, образуя щелочные растворы и выделяя водород. Реакция с водой варьируется в зависимости от металла, но общий паттерн сохраняется.
Еще одно важное свойство щелочных металлов - их реактивность с кислородом. Они активно окисляются воздухом, образуя соответствующие оксиды. Например, литий образует оксид Li2O, натрий - Na2O, калий - K2O и т.д. Оксиды щелочных металлов растворяются в воде, образуя щелочные растворы.
Другие важные свойства группы А металлов включают низкую плотность (в результате низкой атомной массы), низкую плавкость и кипение, а также способность проводить электрический ток.
| Металл | Атомная масса | Плотность | Температура плавления | Температура кипения |
|---|---|---|---|---|
| Литий(Li) | 6.94 | 0.534 г/см³ | 180.54°C | 1342°C |
| Натрий(Na) | 22.99 | 0.97 г/см³ | 97.79°C | 883°C |
| Калий(K) | 39.10 | 0.86 г/см³ | 63.25°C | 759°C |
| Рубидий(Rb) | 85.47 | 1.53 г/см³ | 38.89°C | 686°C |
| Цезий(Cs) | 132.91 | 1.87 г/см³ | 28.44°C | 671°C |
| Франций(Fr) | 223 | 1.87 г/см³ | 27°C | 677°C |
Таким образом, металлы группы А обладают не только сходными химическими свойствами, но и обладают рядом общих физических характеристик. Их проводимость электричества и тепла, а также способность реагировать с водой и кислородом делают их важными элементами во многих химических процессах и промышленных приложениях.
Участие группы А во многих биологических процессах

Группа А в таблице Менделеева, также известная как щелочные металлы, играет важную роль во многих биологических процессах. Эти элементы обладают рядом химических свойств, которые делают их неотъемлемой частью живых организмов.
Один из ключевых биологических процессов, в которых принимают участие элементы группы А, - это передача нервных импульсов. Потенциалы действия в нервных клетках возникают благодаря перемещению ионов натрия и калия через клеточные мембраны. Ионы натрия и калия играют важную роль в электрической разрядке, что позволяет нервным клеткам передавать информацию.
Кроме того, элементы группы А, особенно калий, необходимы для поддержания правильного баланса воды в организме. Калий регулирует уровень жидкости в клетках и внеклеточном пространстве, контролирует давление крови и участвует в метаболических процессах.
Также ионы натрия и калия играют важную роль в мышечной сократимости и контрактивности. Перемещение этих ионов через мембраны клеток миофибрилл позволяет мышцам сокращаться и расслабляться, что является основой для движения организма.
Группа А также неотъемлема часть многочисленных ферментативных реакций, происходящих в организме. Многие ферменты требуют ионы натрия и калия для нормальной работы. Эти ионы помогают управлять активностью ферментов, входя в их состав или регулируя их конформацию.
Таким образом, элементы группы А имеют огромное значение для правильного функционирования живых организмов. Их участие в нервной передаче, поддержании баланса воды, мышечной активности и ферментативных реакциях делает их необходимыми компонентами биологических систем.
| Элемент | Символ | Атомная масса |
|---|---|---|
| Литий | Li | 6,94 |
| Натрий | Na | 22,99 |
| Калий | K | 39,10 |
| Рубидий | Rb | 85,47 |
| Цезий | Cs | 132,91 |
| Франций | Fr | 223,00 |
Использование металлов группы А в промышленности

Металлы группы А в таблице Менделеева, такие как литий, натрий, калий и триохидоксид натрия (щелочные металлы), имеют множество применений в промышленности.
Литий является одним из ключевых материалов для производства аккумуляторных батарей. Он обладает низким весом, высокой энергетической плотностью и длительным сроком службы, что делает его идеальным выбором для использования в портативной электронике, электрических автомобилях и даже в космической промышленности. Кроме того, литий применяется в производстве стекловолокна, керамики и лекарственных препаратов.
Натрий широко используется в производстве щелочей, щелочных и пероксидных исправителей, глазированной и бытовой химии. Это один из основных компонентов веществ, используемых в процессах гидролиза, электролиза, термической обработки и многих других производственных операциях. Также натрий используется в производстве стекла и мыла, а также как ингредиент в пищевой промышленности для консервирования и приправ.
Калий является важным элементом для растений и используется в сельском хозяйстве в виде удобрений. Он улучшает качество и урожайность почвы, способствует развитию корневой системы и поддерживает нормальную функцию растений. Калий также используется в производстве взрывчатых веществ, стекла, мыла и многих других химических соединений.
Триохидроксид натрия, или гидроксид натрия, известный как щелочь, является широко распространенным ингредиентом в различных процессах в промышленности. Он используется в производстве мыла, бумаги, стекла, текстиля, алюминия и других металлов, а также в текстильной и нефтяной промышленности.
Значение группы А для различных отраслей науки и технологий

Группа А элементов в таблице Менделеева включает в себя щелочные металлы, такие как литий, натрий, калий, рубидий, цезий и франций. Эти элементы имеют сходные свойства и обладают высокой реактивностью. Значение группы А для различных отраслей науки и технологий не может быть переоценено.
Благодаря своей химической активности, щелочные металлы находят широкое применение в различных сферах. Они используются в производстве органических синтезов, в качестве катализаторов в химических реакциях, а также в батареях и аккумуляторах. Кроме того, щелочные металлы являются важными компонентами в производстве стекла, сплавов и жаропрочных материалов.
В медицине группа А элементов также играет значительную роль. Многие щелочные металлы используются в процедурах реабилитации и гормональной терапии. Кроме того, некоторые из них используются в качестве лекарственных препаратов для борьбы с различными заболеваниями.
В электронике щелочные металлы применяются в качестве компонентов в литий-ионных аккумуляторах, которые широко используются в мобильных телефонах, ноутбуках и других портативных устройствах. Литий также используется в производстве атомарных и водородных бомб, что демонстрирует его важность для национальной безопасности.
Одним из самых известных применений щелочных металлов является их использование в факеле Мантуа. Этот фонарь освещает многие научные исследования, а также используется в геологии и при осуществлении экспедиций. Кроме того, щелочные металлы играют важную роль в аналитической химии и научных исследованиях, связанных с изучением свойств и реакций различных веществ.
Таким образом, группа А в таблице Менделеева является фундаментальной для различных отраслей науки и технологий. Знание свойств и применений щелочных металлов позволяет создавать новые материалы, разрабатывать новые лекарственные препараты и инновационные технологии, что является основой прогресса во многих областях человеческой деятельности.
| Элемент | Атомный номер | Атомная масса |
|---|---|---|
| Литий | 3 | 6.94 |
| Натрий | 11 | 22.99 |
| Калий | 19 | 39.10 |
| Рубидий | 37 | 85.47 |
| Цезий | 55 | 132.91 |
| Франций | 87 | 223.00 |



