Гидролиз по аниону и катиону – это процесс разложения солей водой на ионы их составляющих. В химии гидролиз является одним из важнейших реакционных механизмов. Понимание принципов гидролиза по аниону и катиону позволяет объяснить множество физико-химических явлений и реакций в растворах.
Гидролиз по аниону обусловлен процессами образования кислоты и основания через реакцию ионов аниона с водой. Если анион обладает достаточной концентрацией электроотрицательных зарядов, то взаимодействие аниона с водой приводит к образованию сильной кислоты. Если же анион обладает достаточной концентрацией электроположительных зарядов, то происходит образование сильного основания. В обоих случаях гидролиз приводит к изменению pH раствора.
Также гидролиз по катиону является важным механизмом гидрохимических процессов. Катион взаимодействует с водой, образуя различные соединения – кислоту, основание или слабый электролит. При этом происходит изменение pH раствора. Гидролиз катиона является одной из причин изменения качества и свойств воды в природных и промышленных системах.
Принципы гидролиза по аниону и катиону

Гидролиз по аниону и катиону представляет собой процесс разложения солей в растворе под влиянием воды. В результате гидролиза происходит образование кислоты или щелочи, что приводит к изменению pH раствора и его химических свойств.
Гидролиз по аниону происходит, когда анион растворяемой соли вступает в реакцию с ионами воды. Если анион соли является слабой основой, то он принимает протон от иона воды H3O+, образуя кислоту. Примером такого гидролиза является гидролиз солей с участием анионов гидроксида (OH-) или карбоната (CO2-3).
Гидролиз по катиону происходит, когда катион растворяемой соли вступает в реакцию с OH- ионами воды. Если катион соли является слабой кислотой, то он отдает протон OH- ионам воды, образуя кислоту. Примерами гидролиза по катиону являются гидролиз солей аммония (NH4+) или алюминия (Al3+).
Результаты гидролиза по аниону и катиону можно представить в виде таблицы:
| Гидролиз по аниону | pH раствора | Химическое свойство раствора |
|---|---|---|
| Гидролиз солей гидроксидов | Ниже 7 | Кислый |
| Гидролиз солей карбонатов | Выше 7 | Щелочной |
| Гидролиз по катиону | pH раствора | Химическое свойство раствора |
|---|---|---|
| Гидролиз солей аммония | Ниже 7 | Кислый |
| Гидролиз солей алюминия | Ниже 7 | Кислый |
Знание принципов гидролиза по аниону и катиону позволяет более точно понять и предсказать химическое поведение солей в растворе и их влияние на pH среды. Это имеет важное значение в различных областях науки и техники, включая химию, биологию и окружающую среду.
Анионный гидролиз
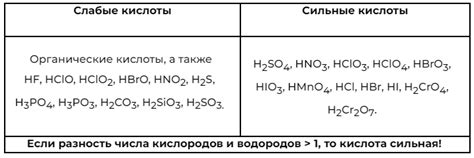
Анионы могут быть различными - гидроксидные, карбонатные, фосфатные, сульфатные и другие. При гидролизе эти анионы реагируют с водой, и в результате образуются гидроксидные или кислотные ионы.
Анионный гидролиз может быть кислотным или щелочным, в зависимости от реакционнных способностей аниона. Когда анионы могут принимать протоны от воды, образуется кислотный гидролиз. Примерами таких анионов являются карбонатные и фосфатные ионы.
Когда анионы могут отдавать гидроксидные ионы, образуется щелочной гидролиз. Примерами таких анионов могут быть гидроксидные и сульфатные ионы.
Иногда анионный гидролиз может вызывать изменение pH раствора, что влияет на химические реакции. Это может быть полезно для регулирования pH в биологических системах, таких как кровь или почвы.
Анионный гидролиз - это сложный процесс, который может иметь много факторов, влияющих на его протекание. Однако, понимание этого процесса важно для химической и биологической науки и позволяет лучше понять и контролировать химические реакции в природных и искусственных системах.
Примеры действия анионного гидролиза

Рассмотрим несколько примеров анионного гидролиза:
1. Гидролиз хлорида аммония (NH4Cl)
Нить NH4Cl → NH4+ + Cl-
Анион хлорида (Cl-) не проявляет свойства основы и не реагирует с водой, поэтому процесс гидролиза будет зависеть от катиона.
Катион аммония (NH4+) встречается с водой реагирует следующим образом:
NH4+ + H2O ⇌ NH3 + H3O+
В результате гидролиза образуется аммиак (NH3) и ион гидроксония (H3O+), которые придают раствору кислотную реакцию.
2. Гидролиз ацетата натрия (CH3COONa)
Нить CH3COONa → CH3COO- + Na+
Анион ацетата (CH3COO-) является основой, и он реагирует с водой следующим образом:
CH3COO- + H2O ⇌ CH3COOH + OH-
В результате гидролиза образуются уксусная кислота (CH3COOH) и гидроксид натрия (OH-), которые придают раствору щелочную реакцию.
3. Гидролиз сульфата магния (MgSO4)
Нить MgSO4 → Mg2+ + SO42-
Анион сульфата (SO42-) не реагирует с водой, но катион магния (Mg2+) проявляет свойство основы и реагирует с водой следующим образом:
Mg2+ + 2H2O ⇌ Mg(OH)2 + 2H+
В результате гидролиза образуется гидроксид магния (Mg(OH)2) и ион водорода (H+), в результате этого раствор имеет щелочную реакцию.
Примеры анионного гидролиза показывают, как различные соли в растворе могут вести себя в зависимости от свойств аниона и катиона. Понимание этих процессов позволяет понять свойства различных химических соединений и участвовать в процессах анионного гидролиза.
Катионный гидролиз

При катионном гидролизе водные молекулы реагируют с катионом, образуя оксационион или гидроксокомплекс. В зависимости от степени диссоциации катиона и его способности образовывать оксационионы или гидроксокомплексы, может возникнуть кислотная или щелочная реакция.
Примером катионного гидролиза может служить гидролиз ионов алюминия (Al3+). Когда ионы алюминия вступают в реакцию с водой, образуется гидроксокомплекс. Этот процесс сопровождается выделением ионов водорода (H+) и приводит к возникновению кислотной реакции:
| Al3+ + 3H2O | → | [Al(H2O)6]3+ + 3H+ |
Катионный гидролиз также может происходить в растворах солей металлов с недостаточно кислотными или щелочными свойствами. В таких случаях катион претерпевает гидролиз, делая раствор кислотным или щелочным.
Таким образом, катионный гидролиз играет важную роль в регулировании pH растворов и может быть использован для титрования и анализа растворов.
Примеры действия катионного гидролиза
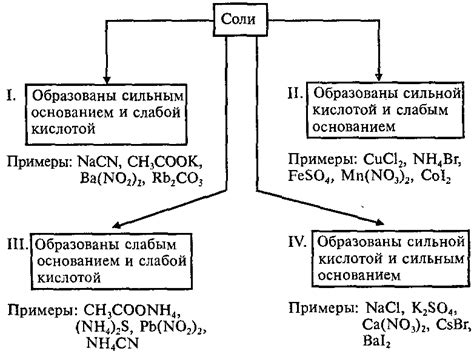
Ниже приведены несколько примеров действия катионного гидролиза:
Гидролиз аммония (NH4+)
Катион аммония реагирует с водой, образуя оксониум-ион (H3O+) и гидроксид-ион (OH-). Это проявляется в формировании слабо щелочного раствора.
Гидролиз алюминия (Al3+)
Катион алюминия реагирует с водой, образуя оксониум-ион (H3O+) и гидроксид-ион (OH-). Это приводит к образованию слабо кислого раствора.
Гидролиз железа (Fe3+)
Катион железа реагирует с водой, образуя оксониум-ион (H3O+) и гидроксид-ион (OH-). Это приводит к образованию слабо кислого раствора.
Катионный гидролиз играет важную роль в химических процессах и имеет множество прикладных применений в различных областях, таких как анализ воды, производство лекарственных препаратов и металлургия.



