Электронная конфигурация ионов играет важную роль в понимании молекулярной структуры и химических свойств веществ. Ионы - это заряженные атомы или группы атомов, которые могут образовываться, когда атомы теряют или получают электроны. Когда атом становится ионом, его электронная конфигурация изменяется, что влияет на его химические свойства.
Ионный заряд определяет, сколько электронов потерял или получил атом. Когда атом теряет электрон или несколько электронов, он становится положительным ионом или катионом. Напротив, когда атом получает электрон или несколько электронов, он становится отрицательным ионом или анионом.
Электронная конфигурация ионов рассчитывается в соответствии с правилами заполнения энергетических уровней и подуровней. Каждый электрон имеет свой спин, который может быть либо "вверх", либо "вниз". По правилу Паули, электронные орбитали заполняются парными электронами с разными спинами в соответствии с принципом наименьшей энергии.
Электронная конфигурация ионов: основные положения
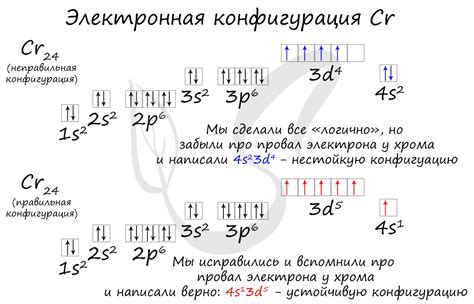
Основным положением в электронной конфигурации ионов является то, что число электронов в ионе равно числу протонов в ядре атома.
Для положительно заряженных ионов, называемых катионами, число электронов меньше числа протонов, что приводит к уменьшению размера атома и повышению энергии ионизации. Для отрицательно заряженных ионов, называемых анионами, число электронов больше числа протонов, что приводит к увеличению размера атома и снижению энергии ионизации.
Ионная конфигурация описывается в виде электронной конфигурации атома и добавления или удаления электронов. Например, натрий имеет электронную конфигурацию [Ne] 3s1, а ион натрия Na+ имеет конфигурацию [Ne]. Это означает, что ион натрия потерял один электрон и теперь имеет положительный заряд +1.
Электронная конфигурация ионов позволяет определить химические свойства ионов, их способность к реакциям и взаимодействию с другими веществами. Это важный инструмент в изучении ионов и их влияния на химические процессы.
Итак, электронная конфигурация ионов является важной составляющей в химии и позволяет более глубоко понять и изучить свойства ионов и их влияние на химические реакции.
Роль электронной конфигурации в химических реакциях

Электронная конфигурация ионов играет важную роль в химических реакциях, определяя их свойства и возможность захвата или отдачи электронов. Ионы могут быть положительно или отрицательно заряженными, в зависимости от того, потеряли они или приобрели один или несколько электронов.
Электронная конфигурация определяет начальные и конечные состояния ионов в реакции, а также изменения их энергетических уровней. Ионы с положительным зарядом, называемые катионами, имеют меньше электронов по сравнению с нейтральным состоянием элемента, что обусловливает их способность принимать электроны и переходить в нейтральное состояние. Ионы с отрицательным зарядом, называемые анионами, имеют больше электронов, что позволяет им отдавать электроны, чтобы достичь более стабильного состояния.
Электронные реакции, такие как окислительно-восстановительные реакции и кислотно-щелочные реакции, зависят от возможности ионов принимать или отдавать электроны. Катионы стремятся принять электроны от анионов, чтобы достичь стабильного электронного состояния, в то время как анионы стремятся передать свои лишние электроны катионам. Эти переходы электронов между ионами и создают необходимый баланс зарядов в химических реакциях.
Электронная конфигурация ионов также определяет их реакционную активность. Ионы с неполной электронной оболочкой, особенно с одним или двумя электронами в валентной оболочке, более реакционноспособны. Это связано с их стремлением достигнуть стабильного состояния за счет принятия или отдачи электронов. Ионы с полностью заполненными электронными оболочками, наоборот, обладают меньшей реакционной активностью, поскольку им уже не требуется приобретение или отдача электронов для достижения стабильности.
В целом, электронная конфигурация ионов является одним из основных факторов, определяющих их способность взаимодействовать с другими ионами и веществами. Знание электронных конфигураций позволяет химикам прогнозировать свойства и реакционную активность различных ионов и использовать эту информацию для синтеза новых материалов и разработки новых химических соединений.
Понятие иона и различие от атома
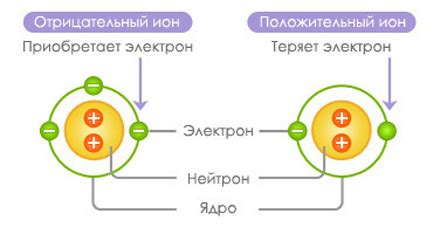
Различие между ионами и атомами заключается в их электрическом заряде. Атомы являются электрически нейтральными и не имеют заряда, поскольку число электронов в них равно числу протонов в ядре. Однако, ионы имеют положительный или отрицательный заряд в результате наличия либо избытка, либо дефицита электронов.
Ионы с положительным зарядом называются катионами и образуются, когда атом или молекула теряют один или несколько электронов. Например, натрий (Na) может потерять один электрон и образовать ион Na+, который является катионом. Ионы с отрицательным зарядом называются анионами и образуются, когда атом или молекула получают один или несколько электронов. Например, хлор (Cl) может получить один электрон и образовать ион Cl-, который является анионом.
Ионы играют важную роль в химии и имеют особые свойства. Благодаря своим зарядам, ионы образуют ионные связи и могут обмениваться электронами с другими атомами или молекулами, что позволяет им образовывать структуры, такие как соли и металлы. Электронная конфигурация ионов определяет их химические свойства и взаимодействия с другими соединениями.
Основные принципы формирования ионов

1. Действие электрических сил. Внешние электрические силы могут влиять на электронную конфигурацию атомов, вызвав потерю или приобретение электронов. Если атому необходимо приобрести один или несколько электронов, он становится отрицательно заряженным ионом, называемым анионом. Если атом потерял один или несколько электронов, он становится положительно заряженным ионом, называемым катионом.
2. Распределение электронов по энергетическим уровням. Электронные уровни, на которых находятся электроны в атоме, определяют его электронную конфигурацию. При образовании ионов, электроны могут перемещаться между различными уровнями энергии. Электроны, находящиеся на более высоком уровне энергии, могут легче быть отрываемыми от атома.
3. Правило октета. Многие атомы стремятся образовать ионы, чтобы достичь стабильной электронной конфигурации, при которой у атома внешний энергетический уровень полностью заполнен восемью электронами. Соответственно, атомы могут потерять или приобрести электроны, чтобы достичь восьмиэлектронной конфигурации, что делает ион более устойчивым.
Ионы играют значительную роль в химии, так как ионные соединения образуются путем притяжения противоположно заряженных ионов. Это приводит к образованию кристаллических решеток ионных соединений, которые имеют особые физические и химические свойства.
Влияние заряда иона на его свойства и химическую активность

Заряд иона играет важную роль в его свойствах и химической активности. Заряд иона определяет его способность взаимодействовать с другими веществами и участвовать в химических реакциях.
Положительно заряженный ион, или катион, обладает свойством притягивать отрицательно заряженные электроны. Это значит, что катионы могут образовывать связи с соединениями, которые содержат атомы со свободными электронными парами. Катионы часто образуют соли, соединения, состоящие из положительно и отрицательно заряженных ионов, так как они могут притягиваться друг к другу силой электростатического притяжения.
Отрицательно заряженный ион, или анион, имеет избыточные электроны и обладает способностью притягивать положительно заряженные частицы, такие как катионы или положительные частицы других молекул. Это позволяет анионам образовывать связи с катионами и другими молекулами. Анионы обычно являются компонентами кислотных соединений и имеют важную роль во многих жизненно важных процессах, таких как регуляция pH в телах организмов.
Заряд иона также может изменять его размер и структуру. Например, заряд может привести к сжатию иона, так как притяжение между электронами и ядром становится сильнее. Это может привести к изменению атомного радиуса ионов и их химических свойств.
В целом, заряд иона является одним из основных факторов, определяющих его свойства и роль в химии. Ионы разных зарядов могут обладать разной химической активностью и способностью взаимодействовать друг с другом и с другими веществами.
Связь электронной конфигурации с местом иона в периодической системе
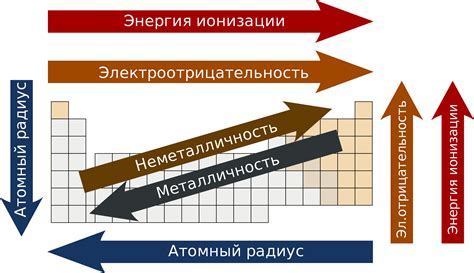
Электронная конфигурация ионов играет важную роль в химии, определяя их свойства и местоположение в периодической системе элементов.
Электронная конфигурация иона зависит от числа электронов и их распределения по энергетическим уровням и атомным орбиталям. Она определяет, как ионы взаимодействуют с другими ионами и молекулами, и какие химические реакции могут происходить.
Место иона в периодической системе также определяется его электронной конфигурацией. Ионы с одинаковым числом электронов, но разным распределением по энергетическим уровням и орбиталям, могут иметь разные свойства и располагаться в разных группах и периодах.
Например, ионы кислорода и серы имеют одну и ту же электронную конфигурацию, но размещены в разных периодах и группах периодической системы. Это объясняется тем, что электронная конфигурация учитывает энергетическую структуру атома ионов, а периодическая система также учитывает химические свойства элементов на основе их реактивности и отношений с другими элементами.
Связь между электронной конфигурацией и местом иона в периодической системе позволяет устанавливать систематику и классифицировать элементы, что имеет большое значение для изучения химических свойств веществ и процессов, а также для разработки новых материалов и применений.
Электронная конфигурация ионов как важный аспект для понимания химических процессов

Как известно, атомы могут взаимодействовать друг с другом, образуя химические связи. В ходе химического взаимодействия атомы могут приобретать или отдавать электроны, превращаясь в ионы. Ионы – это заряженные атомы или молекулы, которые имеют разное количество электронов и, следовательно, различную электронную конфигурацию.
Знание электронной конфигурации ионов позволяет нам понять, как ионы взаимодействуют друг с другом, образуя химические соединения. Правильное понимание электронной конфигурации ионов помогает объяснить реакционную способность вещества и его химические свойства.
К примеру, катионы – положительно заряженные ионы – образуются, когда атом или молекула отдают один или несколько электронов. У катионов электронная конфигурация характеризуется отсутствием одного или нескольких электронов в валентной оболочке. Это позволяет катионам привлекать электроны отрицательно заряженных атомов или молекул, образуя химические связи.
Аналогично, анионы – отрицательно заряженные ионы – формируются, когда атом или молекула принимают один или несколько дополнительных электронов. У анионов электронная конфигурация характеризуется наличием одного или нескольких избыточных электронов в валентной оболочке. Анионы способны отдавать свои избыточные электроны другим атомам или молекулам, создавая связи.
Таким образом, электронная конфигурация ионов влияет на их реакционную способность и способность образовывать химические соединения. Ионная связь, координационные соединения и соединения, образованные другими типами химических связей, основаны на электронной конфигурации ионов.
Знание электронной конфигурации ионов помогает химикам предсказать, какие вещества могут вступать в реакции друг с другом и какие продукты реакции будут образовываться. Также, электронная конфигурация ионов является основой для изучения различных химических процессов, включая электролитические реакции, окислительно-восстановительные реакции и многие другие.
Таким образом, понимание электронной конфигурации ионов является неотъемлемой частью изучения химии и играет важную роль в объяснении химических процессов.



