Электролиз – это процесс разложения вещества под воздействием электрического тока. В ходе электролиза ионы вещества, которые находятся в расплавленном состоянии или в растворе, с помощью электрического тока перемещаются к электродам. Электролиз как метод исследования вещества, а также его применение в различных сферах сделали его одним из основных понятий в физико-химических науках.
Одно из основных направлений применения электролиза – это получение ряды металлов. Например, процесс электролиза используется для получения алюминия. Расплавленный алюминий вместе с криолитом электролизируют, и результатом процесса становится выделение алюминия на одном из электродов. Также, электролиз используется для получения таких важных металлов, как медь, никель, цинк и другие.
Помимо получения металлов, электролиз нашёл своё применение в других сферах. Например, он широко используется в электрохимии для изучения реакций и характеристик различных веществ. Благодаря электролизу были изучены и открыты многие химические элементы, такие как натрий, калий, барий и др. Также, электролиз применяется в сфере энергетики – водород, который можно получить путём разложения воды при электролизе, может быть использован в качестве источника энергии.
Таким образом, электролиз является важным исследовательским и промышленным методом, имеющим широкое применение в различных сферах. Он позволяет получать различные металлы, изучать свойства и реакции веществ, а также быть источником энергии. Изучение электролиза и его применение открывают новые горизонты для развития науки и технологий, а также предоставляют возможности для создания новых материалов и процессов в промышленности.
Что такое электролиз и как он применяется?
Электролиз имеет широкое применение в различных сферах:
- Металлургия и гальваника: Электролиз используется для получения чистых металлов из их солей. Например, электролиз алюминия позволяет получить чистый алюминий из его оксида. Также электролиз применяется для покрытия деталей металлическими покрытиями для защиты от коррозии или улучшения внешнего вида.
- Химическая промышленность: Электролиз используется для производства различных химических веществ. Например, при электролизе растворов солей натрия и хлора образуется сода и хлор, которые широко используются в промышленности.
- Электрохимия и энергетика: Электролиз используется в процессе заряда и разрядки аккумуляторов, а также в процессе электролиза воды для получения водорода и кислорода - экологически чистых источников энергии.
- Аналитическая химия: Электролиз позволяет провести качественный и количественный анализ веществ, исследовать их состав и свойства.
- Медицина: Электролиз используется в процессе электролимфодренажа - методе удаления шлаковых веществ из организма пациента.
Все эти примеры демонстрируют важность электролиза как одного из ключевых процессов в химии и различных областях промышленности и науки.
Принцип электролиза и его определение
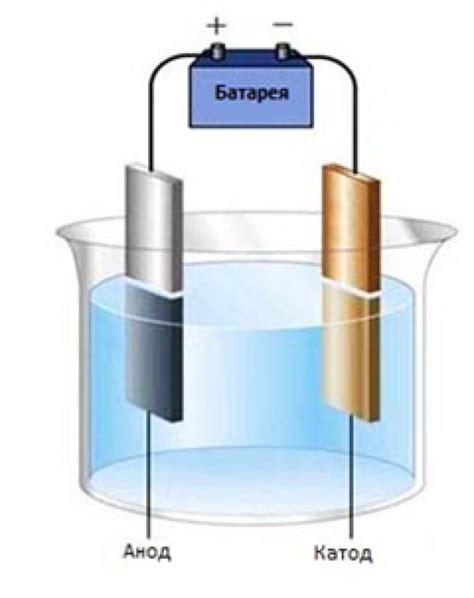
Основным принципом электролиза является создание замкнутой электрической цепи, включающей источник постоянного тока, анод (полюс, с которого вырываются положительно заряженные ионы) и катод (полюс, на который перемещаются отрицательно заряженные ионы). В результате протекания тока происходит окисление вещества на аноде и восстановление на катоде.
Применение электролиза в промышленности
Одним из основных применений электролиза в промышленности является производство металлов. Электролиз используется для получения металлов, таких как алюминий, медь, никель и др. Этот метод позволяет добывать металлы из руд и их соединений, что является эффективным способом получения больших количеств металла.
Кроме того, электролиз применяется в гальванической промышленности. Гальваническое покрытие металлами позволяет защитить поверхность различных изделий от коррозии, а также создать декоративное покрытие. Этот процесс основан на использовании электролитических растворов и проведении электролиза для нанесения тонкого слоя металла на поверхность изделия.
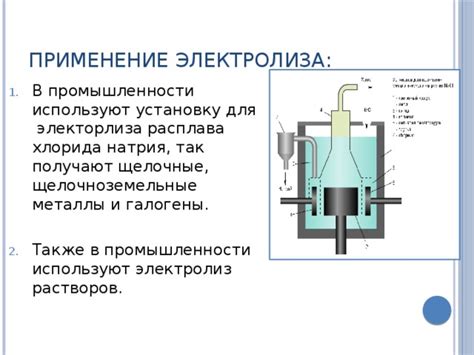
Кроме металлургии и гальванотехники, электролиз применяется в производстве хлора, щелочей и других химических веществ. Процесс электролиза позволяет разложить соединения и получить нужные химические элементы или соединения, используемые в различных отраслях промышленности.
Таким образом, электролиз играет важную роль в промышленности и широко используется для производства металлов, гальванического покрытия и получения химических веществ. Этот процесс позволяет эффективно использовать ресурсы, получать нужные продукты и улучшать качество производства в различных отраслях.
Электролиз в процессах очистки и обработки воды

Электролиз воды позволяет разделить ее на составляющие ее элементы - водород и кислород. Данный процесс может быть использован для получения высокоочищенной воды или для получения энергии водородного топлива.
Когда электрический ток пропускается через воду, происходит процесс электролиза. При этом анод является положительным электродом и окисляется, а катод - отрицательным электродом и восстанавливается. По мере прохождения тока через воду, в анодной части происходит окисление воды и выделение кислорода, а в катодной части - образование водорода и восстановление воды.
Таким образом, электролиз воды позволяет очистить ее от различных примесей и получить высокоочищенную воду. Этот метод очистки воды лежит в основе работы электролизных установок, которые широко применяются в промышленности.
Кроме очистки, электролиз может быть также использован для дезинфекции воды. С помощью электролиза можно уничтожить бактерии и вирусы, которые могут быть в воде. Это особенно важно для обработки питьевой воды и воды, используемой в бассейнах и саунах.
Электролиз как метод получения чистых металлов
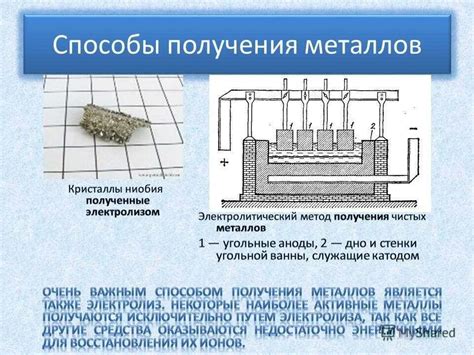
Электролиз используется в металлургической промышленности для получения металлов высокой степени очистки. Процесс основан на разложении растворов солей металлов под воздействием электрического тока.
Для проведения электролиза используются специальные электролизеры, в которых размещаются электролиты – растворы соединений металлов. На анод и катод электролизера подводится электрический ток, который проводит разложение соединений на ионы и обеспечивает их движение через электролит.
В ходе электролиза на катоде осуществляется процесс восстановления металла. Ионы металла соединяются и образуют атомы, которые затем осаждается на поверхности катода. Таким образом, электролиз позволяет получить чистые металлы с высокой степенью очистки от примесей и легированностью.
Электролиз применяется для получения таких ценных металлов, как алюминий, кобальт, медь, золото, серебро и другие. Благодаря использованию электролиза удалось разработать эффективные методы производства этих металлов, что значительно улучшило их доступность и снизило стоимость.
Кроме металлургии, электролиз применяется в других сферах, например, в гальванике для нанесения металлических покрытий, в химической промышленности для синтеза органических и неорганических веществ, а также в энергетике для производства водорода и кислорода.



