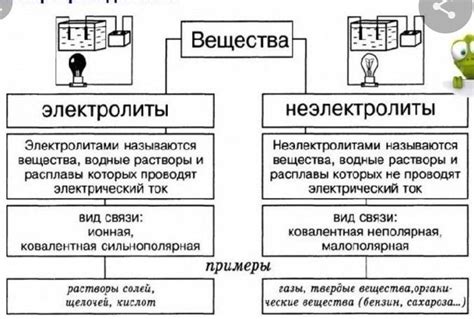
В химии существуют два класса веществ – электролиты и неэлектролиты. Они отличаются по своим свойствам и способности проводить электрический ток. Понимание этих различий имеет большое значение как для научных исследований, так и для повседневной жизни.
Электролиты – это вещества, которые в растворенном состоянии разлагаются на ионы. Ионы являются заряженными частицами, и благодаря их наличию раствор электролита может проводить электрический ток. Как правило, электролитами являются соли и кислоты.
Примеры электролитов:
- Морская соль (NaCl): при растворении в воде она распадается на ионы натрия (Na+) и хлора (Cl-).
- Серная кислота (H2SO4): при растворении она распадается на ионы водорода (H+) и сульфата (SO4^2-).
- Калийев гидроксид (KOH): при растворении он распадается на ионы калия (K+) и гидроксида (ОН-).
Неэлектролиты – это вещества, которые не разлагаются на ионы в растворе. В результате, раствор неэлектролита не проводит электрический ток. В отличие от электролитов, неэлектролиты могут быть как органическими, так и неорганическими соединениями.
Примеры неэлектролитов:
- Сахар (C12H22O11): при растворении в воде он остается в молекулярном виде и не образует ионов.
- Этиловый спирт (C2H5OH): он также остается в молекулярном виде при растворении и не дает ионов.
- Бензол (C6H6): аналогично, он не разлагается на ионы и не проводит электрический ток.
Это лишь некоторые примеры электролитов и неэлектролитов. Понимание этих классов веществ позволяет лучше понять и объяснить множество химических явлений и процессов.
Что такое электролиты и неэлектролиты?
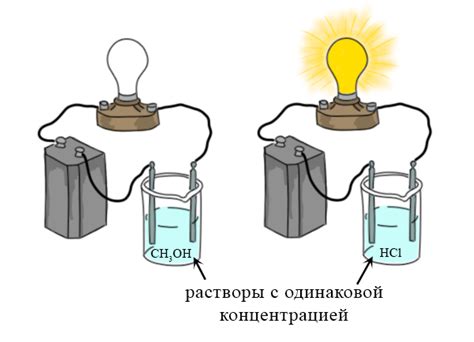
Примерами электролитов могут служить соли, кислоты и щелочи. Натрий хлорид (NaCl), серная кислота (H2SO4) и гидроксид натрия (NaOH) являются типичными представителями электролитов.
Неэлектролиты - это вещества, не способные разлагаться на ионы и образовывать проводящие растворы. В отличие от электролитов, неэлектролиты не создают электрическую проводимость в растворах.
Примерами неэлектролитов могут служить такие вещества, как вода (H2O), спирт (C2H5OH) и сахароза (C12H22O11).
Понимание различий между электролитами и неэлектролитами важно для понимания процессов растворения и электролиза, а также для практического применения в химической и биологической науке, медицине и промышленности.
Определение электролитов и неэлектролитов
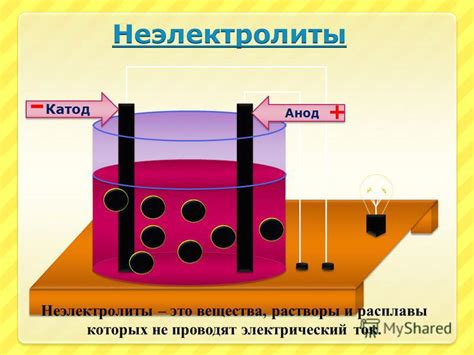
Неэлектролиты, напротив, не разделяются на ионы в растворе или расплавленном состоянии и не могут проводить электрический ток. Они остаются неполярными молекулами и не дают никакой электролитической проводимости. Некоторые примеры неэлектролитов включают в себя сахарозу, спирты и углеводороды.
Различие между электролитами и неэлектролитами основано на способности вещества разделяться на ионы в растворе или расплавленном состоянии. За счет электролитической проводимости, электролиты имеют широкое применение в различных областях, включая химическую промышленность, медицину и электролитическую гальваническую доставку лекарств.
Понимание различия между электролитами и неэлектролитами является важным для понимания многих химических процессов и реакций, а также для правильного применения веществ в различных областях науки и индустрии.
Отличия между электролитами и неэлектролитами
Электролиты:
1. Электролиты - вещества, которые в растворе проводят электрический ток.
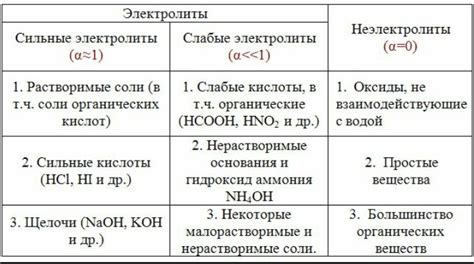
2. Разделяются на две категории: сильные электролиты и слабые электролиты.
3. Сильные электролиты полностью диссоциируются в растворе – разделяются на ионы, которые будут переносить электрический заряд.
4. Слабые электролиты диссоциируются только частично, и только часть молекул распадается на ионы, оставляя остальные в виде недиссоциированных частиц.
5. Примеры электролитов: соль, кислоты, щелочи.
Неэлектролиты:
1. Неэлектролиты - вещества, которые в растворе не проводят электрический ток.
2. Не диссоциируются на ионы и не образуют электрической проводимости.
3. Все молекулы остаются в недиссоциированном виде.
4. Примеры неэлектролитов: глюкоза, спирт, сахар.
Химические свойства электролитов и неэлектролитов
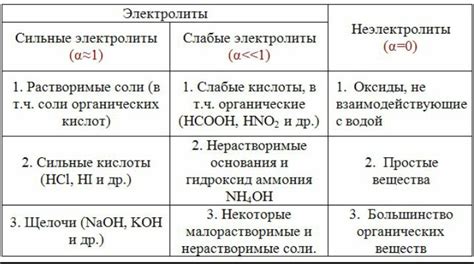
Одним из важнейших свойств электролитов является способность ионизироваться в растворе. В результате процесса ионизации, электролиты делятся на слабые и сильные. Сильные электролиты полностью диссоциируются на ионы, создавая высокую концентрацию движущихся частиц. Слабые электролиты не полностью диссоциируются и образуют низкую концентрацию ионов в растворе.
Примеры сильных электролитов:
- Соляная кислота (HCl)
- Калий гидроксид (KOH)
- Серная кислота (H2SO4)
- Натриевый хлорид (NaCl)
Примеры слабых электролитов:
- Уксусная кислота (CH3COOH)
- Аммиак (NH3)
- Угольная кислота (H2CO3)
- Ацетилсалициловая кислота (C9H8O4)
Неэлектролиты – это химические вещества, которые не ионизируются в растворе и не образуют свободно движущихся ионов. В отличие от электролитов, неэлектролиты не проявляют электропроводность и не способны проводить электрический ток.
Неэлектролиты могут быть молекулярными или атомарными веществами. Эти вещества не образуют ионов при растворении, так как связи между их атомами или молекулами настолько крепкие, что не разрушаются в процессе смешивания с растворителем.
Примеры неэлектролитов:
- Вода (H2O)
- Этиловый спирт (C2H5OH)
- Сахар (C12H22O11)
- Метан (CH4)
Влияние электролитов и неэлектролитов на организм

Электролиты играют важную роль в функционировании организма. Они отвечают за передачу нервных импульсов, поддержание кислотно-щелочного баланса, работу мышц и многие другие процессы. Недостаток или избыток электролитов может привести к различным заболеваниям.
Натрий является одним из основных электролитов, который отвечает за уровень гидратации организма и участвует в передаче нервных импульсов. Снижение или повышение уровня натрия в организме может привести к проблемам с сердцем, почками и нервной системой.
Калий необходим для сокращения мышц, в том числе сердечной мышцы. Нарушение баланса калия может привести к проблемам с сердечно-сосудистой системой, мышечной слабостью и нарушением нервной деятельности.
Кальций является основной составляющей костной ткани и играет ключевую роль в сокращении мышц и свертываемости крови. Недостаток кальция может привести к остеопорозу и ослабленным костям, а избыток - к почечным камням и нарушению сердечного ритма.
Неэлектролиты не проводят электрический ток и не играют такую важную роль в организме, как электролиты. Однако они также могут влиять на самочувствие и здоровье. Например, избыток сахара (неэлектролит) может привести к развитию диабета, а избыток некоторых лекарств (неэлектролитов) может вызвать побочные эффекты.
Понимание важности правильного баланса электролитов и контроля над уровнем неэлектролитов помогает поддерживать здоровье организма и предотвращать возникновение различных заболеваний.
Примеры электролитов

1. Соляная кислота (HCl) - при растворении в воде образует ионы водорода (H+) и хлорида (Cl-), что делает его электролитом.
2. Поваренная соль (NaCl) - также является электролитом, так как при растворении образует ионы натрия (Na+) и хлорида (Cl-).
3. Серная кислота (H2SO4) - при растворении образует ионы водорода (H+) и сульфата (SO4^2-), что делает его электролитом.
4. Калий гидроксид (KOH) - также является электролитом, так как при растворении образует ионы калия (K+) и гидроксида (OH-).
5. Уксусная кислота (CH3COOH) - при растворении образует ионы водорода (H+) и ацетата (CH3COO-), что делает его электролитом.
Это лишь некоторые примеры электролитов, которые могут быть найдены в природе или использоваться в промышленности. Электролиты играют важную роль в химических реакциях и электролитических процессах.
Примеры неэлектролитов
Сахар - это органическое соединение, которое не диссоциирует на ионы в растворе и, следовательно, является неэлектролитом.
Этиленгликоль - это химическое соединение, используемое в антифризе и не является электролитом.
Масло - это неэлектролитное вещество, которое не может проводить электрический ток в растворе.
Бензол - органическое соединение, которое не диссоциирует на ионы и не образует проводящих частиц в растворе.
Спирт - это неэлектролит, так как не диссоциирует на ионы в растворе и не образует проводящих частиц.
Эти примеры демонстрируют важность различия между электролитами и неэлектролитами при изучении свойств химических соединений и растворов.



